
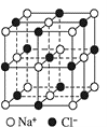
【题目】如图为 NaCl 晶胞结构示意图(晶胞边长为 a nm)。

(1)能准确证明其是晶体的方法是_____
(2)晶体中,Na+位于Cl-所围成的正_____面体的体心, 该多面体的边长是_____nm。
(3)晶体中,在每个Na+的周围与它最近且等距离的 Na+共有_____个。
(4)Na+半径与 Cl-半径的比值是_________(保留小数点后三位, ![]() =1.414。
=1.414。
(5)在 1413℃时,NaCl 晶体转变成氯化钠气体。现有 5.85 g NaCl 晶体,使其汽化,测得气体体积为 1.12 L(已换算为标准状况)。则此时氯化钠气体的分子________。
【答案】X-射线衍射法 或 X-射线衍射实验 八 ![]() 12 0.414 Na2Cl2 或 (NaCl)2
12 0.414 Na2Cl2 或 (NaCl)2
【解析】
(1)X-射线衍射法或X-射线衍射实验能准确确定某种物质是晶体;
(2)晶体中,以Na+为中心在它的上下前后左右有6个Cl-,Na+位于Cl-所围成的正八面体的体心,如图 该多面体的边长=图中对角线长的一半=
该多面体的边长=图中对角线长的一半=![]() nm;
nm;
(3)晶体中,以Na+为中心的三个垂直的面上各有4个Na+,在每个Na+的周围与它最近且等距离的 Na+共有12个。
(4)根据 确定NaCl晶体中阴阳离子的最短距离;
确定NaCl晶体中阴阳离子的最短距离;
(5)M=m/n=mVm/V,根据摩尔质量确定其化学式。
(1)能准确证明其是晶体的方法是X-射线衍射法或X-射线衍射实验;
(2)晶体中,以Na+为中心在它的上下前后左右有6个Cl-,Na+位于Cl-所围成的正八面体的体心,如图 该多面体的边长=图中对角线长的一半=
该多面体的边长=图中对角线长的一半=![]() nm;
nm;
(3)晶体中,以Na+为中心的三个垂直的面上各有4个Na+,在每个Na+的周围与它最近且等距离的 Na+共有12个。
(4)根据图 ,NaCl晶体中阴阳离子的最短距离为a的一半即a/2,氯离子的半径为对角线的1/4,即为
,NaCl晶体中阴阳离子的最短距离为a的一半即a/2,氯离子的半径为对角线的1/4,即为![]() ,由图
,由图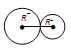 ,钠离子的半径为(a/2-
,钠离子的半径为(a/2-![]() ),所以Na+离子半径与Cl-离子半径之比为 r+/r-=
),所以Na+离子半径与Cl-离子半径之比为 r+/r-=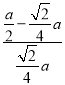 =0.414;
=0.414;
(5)1mol氯化钠的质量=1mol×58.8g·mol-1=58.5g,标况下,气体体积为11.2L的氯化钠的物质的量=11.2L/22.4L·mol-1=0.5mol,M=58.5g/0.5mol=117g·mol-1,所以氯化钠气体的分子式为Na2Cl2。


科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为___________________。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
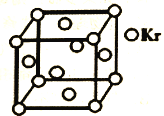
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,则该晶体的密度_____ g/cm3(只列式不计算,Kr摩尔质量为85g·mol—1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验一 碘含量的测定
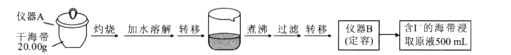
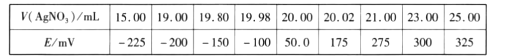
取0.0100 mol/L的 AgNO3标准溶液装入滴定管,取100.00 mL 海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
回答下列问题:
(1)实验中“灼烧”是在___________(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__________________________________
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为___________mL,计算得海带中碘的质量百分含量为_______________________%。
实验二 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
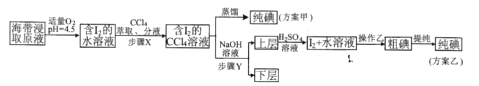
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)“适量O2”中能代替O2的最佳物质对应的电子式为_________________
(5)若要测定“I2+水溶液”中碘的含量,可以选择______________作指示剂,用 Na2S2O3溶液滴定,滴定终点的现象是____________________。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为_________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )
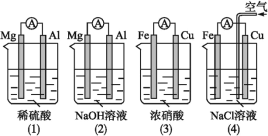
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是
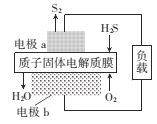
![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
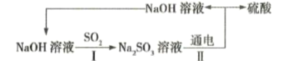
【题目】处理烟气中的![]() 可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
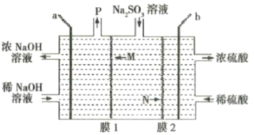
A.膜1为阴离子交换膜,膜2为阳离子交换膜
B.若用锌锰碱性电池为电源,a极与锌极相连
C.a极的电极反应式为![]()
D.若收集![]() 的P(标准状况下),则转移
的P(标准状况下),则转移![]() 电子
电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com