
分析 I.X、Y、Z三种元素,若X+与Y-两种离子具有相同的电子层结构,则X处于ⅠA族、Y处于ⅦA族;Z元素的核内质子数比Y元素核内质子数少9个,若Y为氟元素,其质子数为9,则Z元素质子数为9-9=0,不符合题意,若Y为Cl元素,其质子数为17,则Z的质子数为17-9=8,二者可以形成ClO3-离子,其核外电子数为42,符合题意,若Y为Br元素,其核外电子数为35,则Z原子质子数为35-9=28,不符合题意,故X为K元素、Y为Cl元素、Z为O元素,据此解答;
II.(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(4)118号元素在元素周期表中的第七周期,零族元素,据此分析.
解答 解:I.X、Y、Z三种元素,若X+与Y-两种离子具有相同的电子层结构,则X处于ⅠA族、Y处于ⅦA族;Z元素的核内质子数比Y元素核内质子数少9个,若Y为氟元素,其质子数为9,则Z元素质子数为9-9=0,不符合题意,若Y为Cl元素,其质子数为17,则Z的质子数为17-9=8,二者可以形成ClO3-离子,其核外电子数为42,符合题意,若Y为Br元素,其核外电子数为35,则Z原子质子数为35-9=28,不符合题意,故X为K元素、Y为Cl元素、Z为O元素,
(1)由上述分析可知,Y为Cl元素、Z为O元素;
故答案为:Cl;O;
(2)由K、Cl、O三种元素所形成的含68个电子的盐类化合物的化学式是KClO4,故答案为:KClO4.
II.(3)在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,所以生成1molNH3放出的热量为46KJ.
故答案为:放出;46kJ;
(4)118号元素在元素周期表中的第七周期,零族元素,则116号元素应是第七周期第VIA族;
故答案为:七、VIA.
点评 本题考查结构与性质关系应用、反应热的计算、原子结构排布的规律等,把握从键能的角度计算反应热的方法以及推断元素是解题关键,注意根据离子所带电荷确定在周期表中的大体位置,利用讨论法进行推断,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
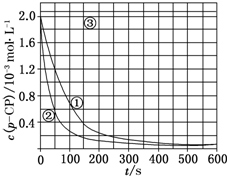 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 能形成+7价含氧酸及其盐的元素一定属于主族元素 | |
| D. | 原子最外层电子数等于6的元素一定属于主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
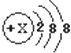
| A. | 第四周期IA | B. | 第三周期0族 | C. | 第二周期VIIA | D. | 第三周期VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Cu2+ Cl- SO42- | B. | HCO3- NO3- Na+ H+ | ||
| C. | SO42- Cl-Na+ K+ | D. | Na+SO42-H+ AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
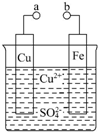 某小组为研究电化学原理,设计如图装置.回答下列问题:
某小组为研究电化学原理,设计如图装置.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
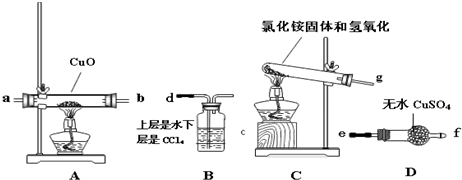
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com