
【题目】下列物质中,使溴水和酸性高锰酸钾溶液都能褪色的是( )
A. 丙烯 B. 苯 C. 乙烷 D. 硝酸
科目:高中化学 来源: 题型:
【题目】钠与水反应的离子方程式正确的是( )
A. 2Na+3H+=2Na++H2↑
B. Na+H2O=Na++OH-+H2↑
C. 2Na+2H2O=2Na++2OH-+H2↑
D. 2Na+2H2O=2Na++O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
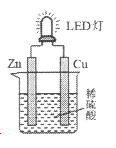
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)![]() H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
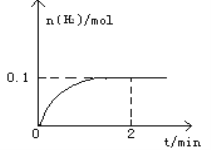
(1)2 min时HI的转化率a(HI)=____________________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________________。
2HI(g)的平衡常数K=________________。
(2)下列哪种情况能说明该反应已经达到平衡状态(___________)
A.气体的密度不再变化了
B.气体的颜色不再变化了
C.气体的总压强不再变化了
D.相同时间内消耗氢气的质量和生成碘的质量相等
E.单位时间内消耗氢气和消耗碘化氢的物质的量相等
F.氢气的质量分数不变了
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) ![]() 2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
反应达到平衡状态,测得体系压强升高。该反应△H____0(填“>”、“<” 或者“=”),简述该反应的平衡常数与温度的变化关系:__________________________________________________。
(4)该反应如果把D的物质的量增大一倍,逆反应速率________(填“增大”、“减小” 或者“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是( )
A.乙醇和乙酸都是常用调味品的成分
B.乙醇、乙烷和乙酸都可与钠反应生成氢气
C.“酒越陈越香”与酯化反应有关
D.乙醇与甲醚(CH3OCH3)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO吸收同时获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) △H2= +113.4 kJ·mol-1
(1)则3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=_________。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(2)从反应开始到平衡,氢气的平均反应速率v(H2)=_________ mol·(L·min) -1。
(3)氢气的转化率=________________________。
(4)该反应的平衡常数为______________________(保留小数点后2位)。
(5)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_________________。
A.升高温度 B.充入He(g),使体系压强增大
C.再充入1 mol H2 D.将H2O(g)从体系中分离出去
(6)当反应达到平衡时,CH3OH的体积分数为m1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,CH3OH的体积分数为m2,则m1________m2的关系(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系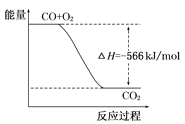
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com