
 常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )
常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | HA是弱酸 | B. | ②处:c(H+)>c(OH-) | ||
| C. | ①处:c(Na+)=c(A-)+c(HA) | D. | ②处:c(Na+)=c(A-)+c(HA) |
分析 A.未加NaOH溶液时溶液的pH大于2,说明HA是弱酸;
B.等体积等浓度的HA和NaOH混合,二者恰好反应生成NaA,②处溶液pH>8,溶液呈碱性;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.未加NaOH溶液时溶液的pH大于2,则氢离子浓度小于0.1mol/L,HA部分电离,由此说明HA是弱酸,故A正确;
B.根据图知,等体积等浓度的HA和NaOH混合,二者恰好反应生成NaA,②处溶液pH>8,溶液呈碱性,则②处:c(H+)<c(OH-),故B错误;
C.①处酸体积是碱2倍,二者物质的量浓度相等,说明2n(NaOH)=n(HA),根据物料守恒得2c(Na+)=c(A-)+c(HA),故C错误;
D.②处酸碱的物质的量相等,根据物料守恒得:c(Na+)=c(A-)+c(HA),故D正确;
故选BC.
点评 本题考查酸碱混合溶液定性判断,为高频考点,正确分析图中曲线变化趋势及溶液中溶质是解本题关键,注意电荷守恒、物料守恒的灵活运用,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 向苦卤中通入Cl2前,可先用稀硫酸酸化 | |
| B. | 工业生产中常选用KOH作为沉淀剂 | |
| C. | 粗盐可采用除杂和重结晶等过程提纯 | |
| D. | 富集溴可用热空气吹出单质溴,原因是溴单质沸点低,易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{18}^{35}$Cl- | B. | ${\;}_{17}^{35}$Cl | C. | ${\;}_{19}^{35}$Cl- | D. | ${\;}_{17}^{35}$Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图为某原电池装置:
如图为某原电池装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Cu、稀硫酸组成原电池,负极反应式为:Al-3e-═Al3+ | |
| C. | 由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| D. | 由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能生成+6价化合物 | B. | 原子的最外层电子数都是6 | ||
| C. | 都能生成稳定的氢化物 | D. | 单质在通常情况下均为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
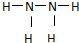 ,过氧化氢的电子式
,过氧化氢的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,C的化学式Cl2.
,C的化学式Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com