
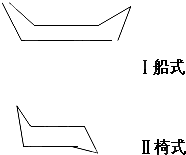
 环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )
环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )| A. | 6种 | B. | 12种 | C. | 14种 | D. | 18种 |
分析 当环已烷的不同碳原子上连有两个甲基时,可以看成环已烷的二元取代产物,然后根据两种空间异构体利用等效氢先写出一元取代产物的种类,最后再写出二元取代产物的种类.
解答 解:环已烷为船式时,共有2种氢原子,所以一元取代产物有2种: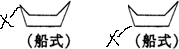 ,
,
一元取代产物再次取代,前者不同碳原子上的二元取代产物有3种,后者不同碳原子上的二元取代产物有3种;
环已烷为椅式时,共有2种氢原子,所以一元取代产物有2种: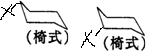 ,
,
一元取代产物再次取代,前者不同碳原子上的二元取代产物有3种,后者不同碳原子上的二元取代产物有3种;所以共有12种.
故选B.
点评 本题主要考查了分异构体,注意等效氢的判断以及分子的空间构型,防止相同结构的出现.


科目:高中化学 来源: 题型:解答题
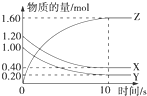 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
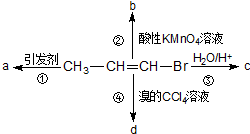 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2COOH | B. | CH3COOCH3 | C. | HCOOCH2CH3 | D. | CH3COCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
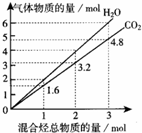 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法错误的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法错误的是( )| A. | 该混合气体中一定含有乙烯 | |
| B. | 该混合气体中有且只有一种烷烃 | |
| C. | 组成该混合气体的烃分子所含氢原子数均为4 | |
| D. | 若混合气体由CH4和C2H4组成,则其体积比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
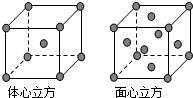 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与Cl2反应制氯乙烷 | B. | 乙醇和浓硫酸共热制乙烯 | ||
| C. | 乙酸和乙醇共热酯化 | D. | 乙烯与氧气在银催化作用下生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com