
| A. | 75% | B. | 50% | C. | 25% | D. | 20% |
分析 合成氨反应为:N2+3H2?2NH3,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,设这三种气体体积分别为6xL、18xL、xL,设N2的转化率为a,则参加反应的氮气体积为6xaL,出口处N2、H2、NH3的体积分别为6x(1-a)L、(18x-18xa)L、(x+6xa)L,出口处N2、H2、NH3的体积比为9:27:8,即6x(1-a)L:(18x-18xa)L:(x+6xa)L=9:27:8,据此计算氮气转化率a.
解答 解:合成氨反应为:N2+3H2?2NH3,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,设这三种气体体积分别为6xL、18xL、xL,设N2的转化率为a,则参加反应的氮气体积为6xaL,出口处N2、H2、NH3的体积分别为6x(1-a)L、(18x-18xa)L、(x+12xa)L,出口处N2、H2、NH3的体积比为9:27:8,即6x(1-a)L:(18x-18xa)L:(x+12xa)L=9:27:8,则氮气转化率a为25%,
故选C.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
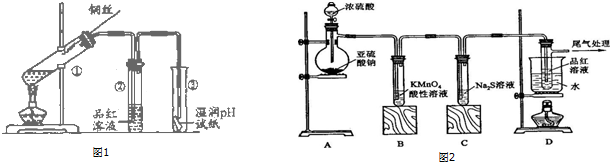
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液 | |
| C. | 滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质R的转化率减少了 | ||
| C. | 物质X的质量分数减少了 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应会放出热量 | |
| B. | 每生成1mol N2,转化电子数为4mol | |
| C. | 等物质的量N2和CO质量相同 | |
| D. | 该反应不需要催化剂常温下也能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com