
| A. | 17.87kJ | B. | -17.87kJ/mol | C. | 411 kJ/mol | D. | -411 kJ/mol |
分析 钠和氯气反应生成氯化钠的化学方程式为:2Na+Cl2=2NaCl,根据反应热与化学计量数成正比计算生成1mo NaCl的反应热,当反应是放热反应△H<0.
解答 解:1.0g钠的物质的量为n=$\frac{m}{M}$=$\frac{1.0g}{23g/mol}$=$\frac{1}{23}$mol,生成氯化钠晶体并放出17.87kJ的热量,钠和氯气反应:2Na+Cl2=2NaCl,1mol钠反应生成1mol氯化钠,反应热与化学计量数成正比,所以生成1mo NaCl的放热为17.87kJ×23≈-411 kJ,当反应是放热反应△H<0,所以反应热为-411KJ/mol,
故选D.
点评 本题考查了反应热的计算,理解热化学方程式的概念和掌握能量变化与化学计量数间的关系是解答关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 因反应太剧烈,可用分液漏斗控制滴水速度来控制反应速度 | |
| B. | 为了得到比较平缓的乙炔气流,可用饱和食盐水代替水 | |
| C. | 乙炔气体中混有PH3和H2S等杂质,可用硫酸铜溶液将其除去 | |
| D. | 为控制反应的速率,可用碳化钙粉末和饱和食盐水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应. ,加聚反应(或聚合反应).
,加聚反应(或聚合反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用铝制容器盛装浓硫酸,说明常温下铝和浓硫酸不反应 | |
| B. | 在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si | |
| C. | 在空气中加热铝箔,发现内部的铝熔化但不滴落,说明铝不易与氧气反应 | |
| D. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

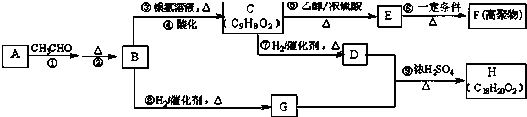
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$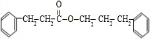 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
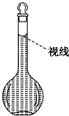 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com