
| A. | 共价化合物中不可能含有离子键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
分析 A.含离子键的一定为离子化合物;
B.硫酸分子中,构成微粒为分子;
C.某元素原子的最外层只有一个电子,可能为H或碱金属元素;
D.化学键通常指的是相邻的两个或多个原子间的强烈的相互作用,化学键包含离子键、共价键.
解答 解:A.含离子键的一定为离子化合物,则共价化合物中不可能含有离子键,故A正确;
B.硫酸分子中,构成微粒为分子,不存在H+和SO42-两种离子,故B错误;
C.某元素原子的最外层只有一个电子,可能为H或碱金属元素,H跟卤素可形成共价键,碱金属跟卤素可能形成离子键,故C正确;
D.离子键是相邻的阴阳离子之间的强烈的相互作用,共价键是存在相邻的原子之间的相互作用,均存在静电作用力,其实质都是电性的相互作用,故D正确;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力及化合物中的化学键判断的考查,选项B为易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
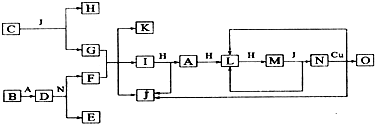
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
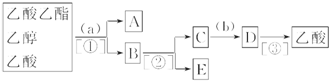
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从上到下,第IA族元素单质的密度逐渐增大 | |
| B. | 从上到下,第IA族元素单质的熔点逐渐降低 | |
| C. | 从上到下,第ⅦA族元素其氢化物的稳定性逐渐增强 | |
| D. | 从上到下,第ⅦA族元素其氢化物的沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们单质的熔、沸点随核电荷数的增加逐渐降低 | |
| B. | 元素的非金属性随核电荷数的增加逐渐减小 | |
| C. | 它们原子的氧化性随核电荷数的增加逐渐增强 | |
| D. | 它们氢化物的稳定性随核电荷数的增加逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和Cl2光照取代 | B. | 乙烯和Cl2加成 | ||
| C. | 乙烯与HCl加成 | D. | 乙烯和H2加成后再与Cl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com