
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。
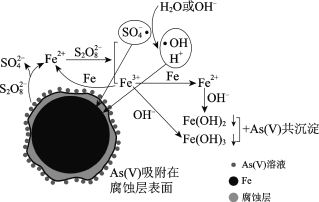
零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。
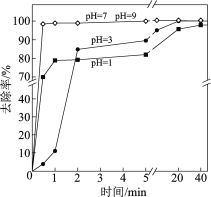
【答案】第4周期、第ⅤA族 H3AsO4 弱 +7 Fe+ S2O82 == Fe 2+ +2SO42 Fe+ 2Fe 3+ == 3Fe 2+ pH = 7和pH = 9时,产生了具有强氧化性的SO4·和·OH,利于生成Fe2+和Fe3+,pH = 7和pH = 9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)
【解析】
(1)①磷核电荷数为15,在元素周期表中的位置是第3周期、第ⅤA族;
②磷酸的化学式为H3PO4,同主族元素核电荷数越大,非金属性越弱,其最高价氧化物水化物的酸性越弱;
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中氧元素为-2价,设S的化合价是x,结合正负化合价代数和为-2计算;
②零价铁与过硫酸钠反应生成Fe2+和SO42-,结合守恒法写出发生反应的离子方程式;
③Fe将Fe3+还原为Fe2+,结合守恒法写出发生反应的离子方程式;
(3)由模型可知pH = 7和pH = 9时产生了强氧化性的O4·和·OH,有利于Fe的氧化,pH = 7和pH = 9时Fe2+和Fe3+完全转化为Fe(OH)2和Fe(OH)3,易除去;
(1)①磷核电荷数为15,在元素周期表中的位置是第3周期、第ⅤA族,则砷在元素周期表中的位置是第4周期、第ⅤA族;
② 砷酸中砷元素的化合价为+5价,其化学式是H3AsO4,因As非金属性比P弱,则其酸性比H3PO4弱;
(2)①S2O82中氧元素为-2价,设S的化合价是x,2x+(-2)×8=-2,解得x=+7,即S2O82中S的化合价是+7;
②零价铁与过硫酸钠反应生成Fe2+和SO42-,则发生反应的离子方程式为Fe+ S2O82 == Fe 2+ +2SO42;
③Fe将Fe3+还原为Fe2+,发生反应的离子方程式为Fe+ 2Fe 3+ == 3Fe 2+;
(3)结合零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型可知,因pH = 7和pH = 9时,产生了具有强氧化性的SO4·和·OH,利于生成Fe2+和Fe3+,pH = 7和pH = 9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ),故5 min内pH = 7和pH = 9时去除率高。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 粗铜电解精炼时,粗铜、纯铜依次分别作阴极、阳极
B. 5.6 g Fe在足量Cl2中充分燃烧,转移电子的数目为0.2×6.02×1023
C. 室温下,稀释0.1 mol/L NH4Cl溶液,溶液中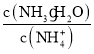 增大
增大
D. 向BaCO3、BaSO4的饱和溶液中加入少量BaCl2,溶液中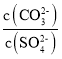 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A. 2a2=a1=197 kJ B. 2a2<a1<197 kJ
C. a2>a1>197 kJ D. 197 kJ>a1=2a2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途

下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,一定条件下可以发生如下转化(水参与的反应,水未标出)。
![]()
(1)符合上述转化关系的A、X、B、C为____________________(填字母代号)
a.NaOHCO2Na2CO3NaHCO3 b.NaO2Na2ONa2O2
c.NH3 O2 NO NO2 d.FeCl2 FeCl2 FeCl3
(2)X为无色无味能使澄清石灰水变浑浊的气体,则C为_________________(填化学式)。若B中混有少量C杂质,除杂的化学方程式为_________________。
(3)C为红棕色气体,则A是_______或________(填化学式),若A的水溶液显碱性,写出A→B的化学方程式______________________________,B和C可相互转化,写出C→B的化学方程式_____________________________。
(4)若C为淡黄色固体,则B为___________,写出C在潜水艇中作为供氧剂牵涉的两个反应方程式__________、________。
(5)除(1)涉及的转化外,再写出一组符合转换关系的A、X、B、C ____ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、Cr3+对环境具有极强的污染性,含有
、Cr3+对环境具有极强的污染性,含有![]() 、Cr3+的工业废水常采用NaOH沉淀方法除去。
、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成![]() :Cr3++3OH
:Cr3++3OH![]() Cr(OH)3
Cr(OH)3![]()
![]() +H++H2O。②
+H++H2O。②![]() 还原产物为Cr3+。③lg3.3=0.50。
还原产物为Cr3+。③lg3.3=0.50。
请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)根据2![]() +2H+
+2H+![]()
![]() +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
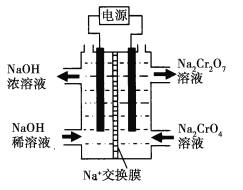
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为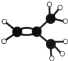 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
A. X为0.2 mol·L-1
B. Y为0.1 mol·L-1
C. Z为0.3 mol·L-1
D. Z为0.1 mol·L-1时,Y为0.45 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com