
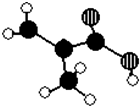
 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).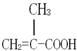 ,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.
,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.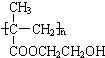 .
. 分析 (1)该物质的结构简式为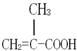 ;分子中含有3种性质不同的H;
;分子中含有3种性质不同的H;
(2)分子式相同,结构不同的化合物互为同分异构体,结构相似,在组成上相差1个或若干个CH2原子团的物质互为同系物,据此进行判断,注意含有官能团的同系物中,官能团数目与种类相同;
(3)CH3C=CH2COOH与乙二醇反应可得到分子式为C6H10O3的物质,该物质的结构简式为:CH3C=CH2COOCH2CH2OH,分子中含有C=C双键,反应加聚反应生成高聚物.
解答 解:(1)黑色球为C原子,白色球为H原子,斜线球为O原子,由结构可知,该有机物的结构简式为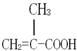 ,分子中含有3种性质不同的H,该化合物的核磁共振氢谱中有3个吸收峰
,分子中含有3种性质不同的H,该化合物的核磁共振氢谱中有3个吸收峰
故答案为: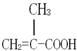 ;3;
;3;
(2))①CH3CH=CHCOOH与CH3C=CH2COOH,分子式相同,C=C双键位置不同,二者互为同分异构体,
②CH2=CHCOOCH3 与CH3C=CH2COOH,分子式相同,含有的官能团种类不与完全相同,前者含有酯基、后者含有羧基,二者互为同分异构体,
③CH3CH2CH=CHCOOH与CH3C=CH2COOH互为同系物,
④CH3CH(CH3)COOH与CH3C=CH2COOH,分子式不与相同,含有的官能团种类不与完全相同,前者只含有羧基、后者含有羧基与C=C,二者不是同分异构体,也不是同系物,
故答案为:①②;③;
(3)CH3C=CH2COOH与乙二醇反应可得到分子式为C6H10O3的物质,该物质的结构简式为:CH3C=CH2COOCH2CH2OH,分子中含有C=C双键,反应加聚反应生成高聚物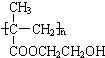 ,
,
故答案为: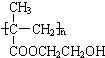 .
.
点评 本题考查有机物的性质以及结构、同分异构体、同系物等知识,为高频考点,侧重于学生的分析能力的考查,难度不大,注意(1)中结构简式书写,球与球之间的连线代表化学键,不一定是单键.


科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | 氢化物的沸点为H2T<H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
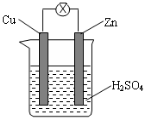
| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<D<C<B | |
| B. | 非金属性:C>D | |
| C. | 氢化物的热稳定性:C>A | |
| D. | 单质B常温下能溶于浓硝酸但不能溶于氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子:$\underset{\stackrel{••}{Cl}}{••}$• | B. | 硫离子:$\underset{\stackrel{••}{S}}{••}$:2- | C. | 溴离子[:$\underset{\stackrel{••}{Br}}{••}$:]- | D. | 钙离子Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
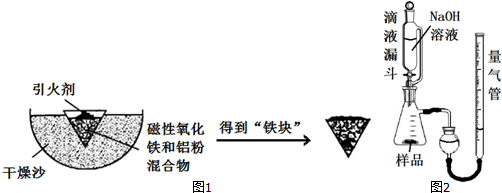

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com