
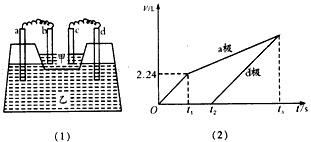
科目:高中化学 来源: 题型:阅读理解
| 53(b-a) |
| 22a |
| 53(b-a) |
| 22a |
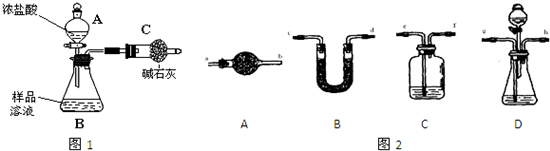
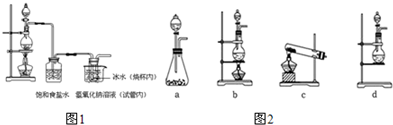
| 选用的仪器 | C C |
D D |
C C |
B B |
A A |
| 添加的药品 (必要的操作) |
装有氢氧化钠溶液,从e通入空气 装有氢氧化钠溶液,从e通入空气 |
分液漏斗装稀硫酸,锥形瓶内装样品溶液 分液漏斗装稀硫酸,锥形瓶内装样品溶液 |
浓硫酸 浓硫酸 |
碱石灰,反应前后分别称量质量 碱石灰,反应前后分别称量质量 |
碱石灰 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 气体 | 装置连接顺序(填字母) | 制作反应的化学方程式 | ||||||
| (1) | 乙烯 | B→D→E B→D→E |
CH3-CH2-OH
CH3-CH2-OH
| ||||||
| (2) | 乙炔 | A→C→E | CaC2+2H2O=Ca(OH)2+C2H2↑ CaC2+2H2O=Ca(OH)2+C2H2↑ |
| 催化剂 |
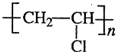 .
.| 催化剂 |
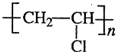 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀硝酸 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 电石、饱和食盐水 | C2H2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
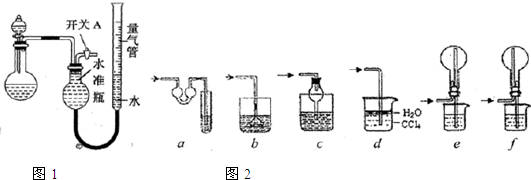
| 编号 | 镁铝合金质量 | 量气管第1次读数 | 量气管第2次读数 |
| ① | 1.0g | 10.0mL | 347.5mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 344.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com