
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
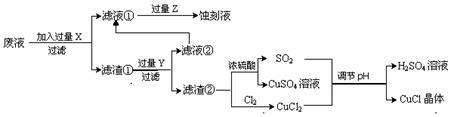
|
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是_____________________。
(2)写出生产过程中X:____ ______ Y:_____ _____ (填化学式)。
(3)写出产生CuCl的化学方程式:_________________________________________。
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是:______________________________。
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
________________________________ _____。
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
科目:高中化学 来源: 题型:
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下2SO2(g)+O2(g)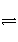
 2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2 B.Q1>Q2>Q C.Q1>Q>Q2 D.Q1=Q2>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。 A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为
。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
 (3)A的一种单质相对分子质量为720,分子构型为一个32面体,
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,
|
种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示
 的堆积方式。则这种堆积模型的配位数为 ,
的堆积方式。则这种堆积模型的配位数为 ,
如果X的原子半径为a cm,阿伏加德常数的值为
NA,则计算此单质的密度表达式为 g/cm3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组对溶液作如下的归纳总结(均在常温下)。其中正确的是( )
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+ 物质的量前者大
③在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32-
④pH=4、浓度均为0.1 mol·L-1 的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10) mol/L
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物:①CH2OH(CHOH)4CHO;②CH3CH2CH2OH;③CH2===CHCH2OH;④CH2===CH—COOCH3;⑤CH2===CH—COOH中既能发生加成、酯化反应,又能发生氧化反应的是( )
A.③⑤ B.①③⑤ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
.用某种酸处理高岭石时,会得到一种沉淀,该沉淀由X、Y、Z、W四种短周期元素组成,它的化学式为XYZW6,其中X、Y、Z位于同一周期且最外层电子数依次增大,Y2+与W-具有相同电子层结构,下列说法正确的是
A. 离子半径:Y2+>W- B. 原子半径:X>Y>Z>W
C. 单质沸点:X>Y>Z>W D.四种元素的简单离子均能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列化合物的名称或结构简式:

(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如下:
①麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
②下列各物质:
 与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com