
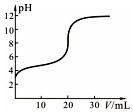
 25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )
25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )| A. | V=0.00 mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol•L-1 | |
| B. | V=10.00 mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-) | |
| C. | 溶液pH=7时,$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1 | |
| D. | V≥20.00 mL时,溶液中c(K+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
分析 A.CH3COOH溶液pH=3,则c(CH3COO-)=c(H+)=10-3mol•L-1,K=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$;
B.V=10.00 mL时,醋酸剩余,溶液中为等量的CH3COOH、CH3COOK;
C.溶液pH=7时,c(H+)=c(OH-),由电荷守恒可知c(CH3COO-)=c(K+);
D.V=20.00 mL时,恰好生成CH3COOK,由物料守恒可知c(K+)=c(CH3COO-)+c(CH3COOH).
解答 解:A.CH3COOH溶液pH=3,则c(CH3COO-)=c(H+)=10-3mol•L-1,K=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$≈10-5mol•L-1,故A正确;
B.V=10.00 mL时,醋酸剩余,溶液中为等量的CH3COOH、CH3COOK,溶液显酸性,则溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-),故B正确;
C.溶液pH=7时,c(H+)=c(OH-),由电荷守恒可知c(CH3COO-)=c(K+),则$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1,故C正确;
D.V=20.00 mL时,恰好生成CH3COOK,由物料守恒可知c(K+)=c(CH3COO-)+c(CH3COOH),V>20.00mL时KOH过量,故D错误;
故选D.
点评 本题考查酸碱中和滴定,为高频考点,把握酸碱反应及图象分析为解答本题的关键,侧重分析与应用能力的考查,注意电荷守恒及物料守恒的应用及溶质判断,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:推断题
| I/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 496 | 4562 | 6912 | 9540 |
| Z | 577 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、CO32-、OH- | B. | Na+、Ba2+、SO4 2-、NO3-- | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | Na+、Mg2+、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| B. | 古方记载:“青蒿一捏,以水二升渍,绞其汁”,所述过程不涉及化学变化 | |
| C. | 绿色化学的核心是减少和消除工业生产对环境的污染 | |
| D. | 通过煤的干馏、气化、液化能获得多种化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醚和乙醇互为同分异构体 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 聚氯乙烯可用作生产食品包装材料的原料 | |
| D. | 分子式为C3H8O的有机物,只有2种能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
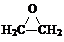 +CaCl2+H2O.
+CaCl2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HR溶液中滴加紫色石蕊试液,溶液变红色 | |
| B. | 室温时,NaR溶液的pH大于7 | |
| C. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 | |
| D. | 室温时,0.01 mol•L-1的HR溶液pH=4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com