
 .
.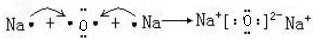 .
. .元素D在元素周期表中的位置是第三周期第VIIA族.
.元素D在元素周期表中的位置是第三周期第VIIA族.分析 地壳中含量最高的元素是O元素,故A为O,D的氢化物和最高价氧化物对应的水化物均为强酸,应为Cl元素,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,则C为Al元素,B为Na元素,E的原子数序最大,且位于20号元素之内,E和其他元素既不在同一周期也不在同一主族,应为Ca元素,根据对应原子结构特点以及对应单质、化合物的性质解答该题即可.
解答 解:依据分析可知:A为O、B为Na、C为Al、D为Cl、E为Ca,
(1)氧气单质中两个O原子形成2对共价键,故结构式为O=O,Na的最高价氧化物的水化物为氢氧化钠,氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故答案为:O=O;
,故答案为:O=O; ;
;
(2)B2A是Na2O,Na2O为离子化合物,用电子式表示Na2O的形成过程为: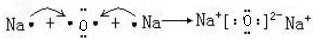 ,
,
故答案为: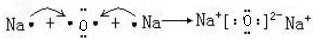 ;
;
(3)由于H2O分子间存在氢键,其沸点高于HCl,故答案为:H2O;
(4)E为Ca,有4个电子层,最外层电子数为2,失去最外层2个电子形成阳离子,离子结构示意图为: ,Cl的原子核外有3个电子层,最外层电子数为7,则位于第三周期VIIA族,故答案为:
,Cl的原子核外有3个电子层,最外层电子数为7,则位于第三周期VIIA族,故答案为: ;第三周期VIIA族;
;第三周期VIIA族;
(5)钙、氯、氧可形成Ca(ClO)2、Ca(ClO3)2、Ca(ClO4)2,其中满足题设条件下的盐为Ca(ClO)2(次氯酸钙),由于在酸性环境中ClO-具有强氧化性,Cl-具有还原性,二者发生氧化还原反应生成Cl2和H2O,离子反应为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:次氯酸钙;ClO-+2H++Cl-═Cl2↑+H2O.
点评 本题考查元素的推断,题目难度中等,以此为载体,考查了结构式、电子式的书写,离子化合物的形成过程,离子结构示意图、离子反应方程式书写等,综合性较强,注意整理.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
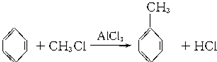 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3-CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方案 | 实验步骤 | 实验现象 | 结论 | 有关反应的化学方程式 |
| 1 | 取少量待测溶液,向其中滴加适量BaCl2溶液 | |||
| 2 | 猜想②正确 | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非电解质溶于水得到的溶液 | |
| B. | c(H+)、c(OH-)均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应的发生均无需加热 | |
| B. | 凡是需要加热后才能发生的反应一定是吸热反应 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 物质发生化学反应都伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | B. | 稳定性HX>H2Y>ZH3 | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性Z3->Y2->X- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时,X可以显负价,Y显正价 | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 第一电离能可能Y小于X | |
| D. | 最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
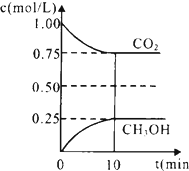 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
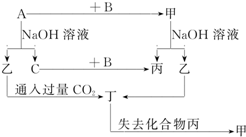 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com