
| A. | 生铁和钢都属于合金 | |
| B. | 明矾可用作混凝剂去除水中的悬浮物 | |
| C. | 食盐水、稀豆浆、糖水都能产生丁达尔效应 | |
| D. | 以次氯酸钠为有效成分的漂白液可为泳池消毒 |
分析 A.生铁和钢均为Fe的合金;
B.明矾中铝离子水解生成胶体,具有吸附性;
C.丁达尔效应为胶体的性质,而食盐水和糖水为溶液;
D.次氯酸钠具有强氧化性.
解答 解:A.生铁和钢均为Fe的合金,还含碳等,故A正确;
B.明矾中铝离子水解生成胶体,具有吸附性,则明矾可用作混凝剂去除水中的悬浮物,故B正确;
C.丁达尔效应为胶体的性质,而食盐水和糖水为溶液,只有稀豆浆能产生丁达尔效应,故C错误;
D.次氯酸钠具有强氧化性,则以次氯酸钠为有效成分的漂白液可为泳池消毒,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应及性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
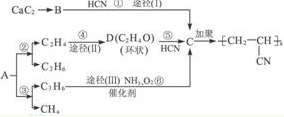 人造羊毛的主要成分为聚丙烯腈
人造羊毛的主要成分为聚丙烯腈 ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.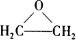 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室以2一丁醇(
实验室以2一丁醇( )为原料制备2-氯丁烷
)为原料制备2-氯丁烷 ),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:
),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:| 物质 | 熔点 (℃) | 沸点(℃) |
| 2-丁醇 | -114.7 | 99.5 |
| 2-氯乙烷 | -131.3 | 68.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯胺处理自来水:NH2Cl+H2O?NH2OH+HCl | |
| B. | 在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水:Ca2++Mg2++2OH-+2HCO3-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 长时间煮沸含Mg2+、HCO3-的自来水:Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑ | |
| D. | Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为:Fe3++3H2O═Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>H2S | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com