
����Ŀ���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO(g)+2H2 (g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
![]()
�ɱ��������жϦ�H________0 (�����������������)����ѧƽ�ⳣ������ʽK=________��
��2��300��ʱ�������Ϊ2.0 L���ܱ�������ͨ��2 mol CO��4 mol H2������20 s�ﵽƽ��״̬��
������20 s��CO�ķ�Ӧ����Ϊ________����ʱ�����м״����������Ϊ_________��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬ƽ���ƶ������__________(����ҡ����������ƶ���)��ԭ����________________________
��3����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2 (g) = 2CO2 (g)��4H2O(g) ��H����1277.0kJ/mol
��2CO(g)+O2 (g) = 2CO2(g) ��H����566.0kJ/mol
��H2O(g) =H2O(l) ��H����44kJ/molд���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
__________________��
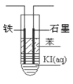
��4���״�������������ȼ�ϵ�أ�д������������Ϊ����ʼ״�ȼ�ϵ�ظ�����Ӧʽ_______________����ͼ�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫�뼫___________�������������ӣ�ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ϲ���ҺΪ_______ɫ������ 1.27g�ⵥ������ʱ,��Ҫ_______g CH3OH��
���𰸡�
��1���� �� ![]()
��2����0.025mol/(L��s) 25% �� ����������ʱŨ����Qc=![]() =0.25
=0.25
��3��-443.5kJmol-1
��4��CH3OH-6e-+8OH-=CO32-+6H2O�������Ϻ��� 0.053
��������
�����������1�����ݱ����¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵������ƽ�����淴Ӧ�����ƶ������Ը÷�Ӧ�Ƿ��ȷ�Ӧ������H1��0����ѧƽ�ⳣ���ı���ʽK=![]() ��
��
��2���� CO(g)+2H2 (g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��ʼŨ�ȣ�mol/L�� 1 2 0
�仯Ũ�ȣ�mol/L�� c 2c c
ƽ��Ũ�ȣ�mol/L�� 1-c 2-2c c
��ʱƽ�ⳣ��K=1=![]() ����ã�c=0.5mol/L��20 s��CO�ķ�Ӧ����Ϊ
����ã�c=0.5mol/L��20 s��CO�ķ�Ӧ����Ϊ![]() =
=![]() =0.025mol/(L��s)����ʱ�����м״����������Ϊ
=0.025mol/(L��s)����ʱ�����м״����������Ϊ![]() ��100%=25%��
��100%=25%��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬��ʱQc=![]() =0.25��K����ʱƽ�������ƶ���
=0.25��K����ʱƽ�������ƶ���
��3�����ݸ�˹���ɣ�����֪��Ӧ����-��+����4����2�õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ����H=![]() [��-1277.0kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-443.5kJmol-1��
[��-1277.0kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-443.5kJmol-1��
��4������������Ϊ����ʼ״�ȼ�ϵ�ظ�����ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��I-����������ΪI2����Fe������������ֻ�������������Դ����������ͨ��һ��ʱ������ɵĵⵥ���ܽ��ڱ��У������ܶȱ�ˮС�����ϲ㣬Ϊ�ܽ����Ϻ�ɫ��Һ������1.27g�ⵥ������ʱ��ת�Ƶ���Ϊ0.01mol����Ҫ��CH3OH����Ϊ![]() ��32g/mol=0.053g��
��32g/mol=0.053g��


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ���Ũ���ᡢŨ���ᰴ����ͼװ����ȡ���������ش��������⣺

��1�������ƻ����ʱӦ��___________���뵽___________��ȥ��
��2����ˮԡ���ȵ��Թܿڴ���Ҫ��һ�����ܣ�������___________��
��3���÷�Ӧ�Ļ�ѧ����ʽ��___________����Ӧ���ͣ�___________��
��4����װ�ô��ڼ����������ģ��ɲ�������������______����______��
��________��
��5��������в�������������ˮϴ�����ø�������
����10��NaOH��Һϴ����ˮϴ��ѡ����ʲ��������з�������Ĵֲ�Ʒ���ƣ���Һ________��Һ________��Һ________����________��������ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����̬��ԭ�ӵļ۵����Ų�ͼΪ
��2����֪TiCl4��ͨ�����������ɫҺ�壬�۵�Ϊ��37�� ���е�Ϊ136�� ����֪TiCl4Ϊ ���壮
��3���������Ѿ�����������Ϊ��״�ۺ���ʽ�����ӣ��ṹ��ͼ��ʾ����������Ti��O��ԭ����֮��Ϊ ��
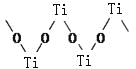
��4��Co��һ��������ľ�����ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ���� �����������Ͽ�ѧ����ʵ����һ������С�鷢������5K�³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ�ӣ��������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ����� ��


��5����C��Mg��Ni����Ԫ����ɵ�һ�ּ������ṹ�Ļ�������г����ԣ��侧����Cλ������λ�ã�Mgλ�ڶ��ǣ�Niռ������λ�ã��û�����Ļ�ѧʽΪ ��������Mgԭ����Χ���������Niԭ���� ���������ͳ������Ͼ�������a=0.38nm������þ�����ܶ� ��gcm��3����������λ��Ч���֣�
��6�������Ѿ����ṹ��ͼ��ʾ������ԭ�ӵİ뾶Ϊr����þ�������ı���ʽΪ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�����ܱ������У��������·�Ӧ��2A(g)��B(g)![]() 2C(g)��D(g)������������A��B����4 mol����ǰ10����A��ƽ����Ӧ����Ϊ0��12 mol/(L��s)����10����ʱ��������B�����ʵ�����
2C(g)��D(g)������������A��B����4 mol����ǰ10����A��ƽ����Ӧ����Ϊ0��12 mol/(L��s)����10����ʱ��������B�����ʵ�����
A. 1��6 mol B. 2��8 mol C. 2��4 mol D. 1��2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦFe��H2SO4===FeSO4��H2���������仯���ƣ���ͼ��ʾ��
��1���÷�ӦΪ________��Ӧ(����ȡ����ȡ�)��
��2����Ҫʹ�÷�Ӧ�ķ�Ӧ���ʼӿ죬���д�ʩ���е���_____(����ĸ)��
A������ƬΪ���� B������ѹǿ
C�������¶� D����ϡ����Ϊ98%��Ũ����
��3������������Ӧ��Ƴ�ԭ��أ�ͭΪԭ���ijһ�����ϣ���ͭΪ______��(���������)��ͭƬ�ϲ���������Ϊ________________���ü��Ϸ����ĵ缫��ӦΪ______________�����·�е����� _______����_______���ƶ���(���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��ı仯������ͼ�����б�������ȷ����( )
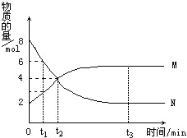
A����Ӧ�Ļ�ѧ����ʽΪ��2M![]() N
N
B��t2ʱ�����淴Ӧ������ȣ��ﵽƽ��
C��t3ʱ������Ӧ���ʴ����淴Ӧ����
D��t1ʱ��N��Ũ����MŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��ѧ���õ��Լ�����ҵ�������̿��Ʊ���������������£�
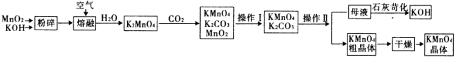
��1�������ƣ�NaBiO3��������ˮ�����ڶ��Լ���������Һ��Mn2+�Ĵ��ڣ���Ļ�ԭ����ΪBi3������Mn2������������ΪMnO4����д����Ӧ�����ӷ���ʽ_________________________________________��
��2��KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������������ͬ����_____������ţ���
a��84����Һ��NaClO��Һ�� b��˫��ˮ c������ d��75%�ƾ�
��3�����������п���ѭ��ʹ�õ��������������غ�_______��д��ѧʽ����
��4�������ϣ�������������ѭ�����Ʊ������е���ʧ��1 mol MnO2���Ƶ�_____mol KMnO4��
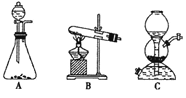
��5������������Ҫ������CO2���塣д��ʵ������ȡCO2�Ļ�ѧ����ʽ___________________���������巢��װ�ÿ�����______��ѡ����ţ���
��6����������������________������������ KMnO4��K2CO3��������______�������ʣ��ϵIJ��죬
����__________����������裩�����ȹ��˵õ� KMnO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B����������֪A�ķ���ʽΪC5Hm����B�����ʽΪC5Hn��m��n��Ϊ������������ش��������⣺
��1�����й�����A����B��˵������ȷ���� ������ţ���
a����A����B���ܻ�Ϊͬϵ��
b����A����B���ܻ�Ϊͬ���칹��
c����m=12ʱ����Aһ��Ϊ����
d����n=11ʱ����B���ܵķ���ʽ��2��
��2������AΪ�������ҷ���������̼ԭ��һ�����棬��һ�������£�1mol A������1mol H2�ӳɣ���A�������� ��
��3������BΪ����ͬϵ�ȡһ��������B��ȫȼ�պ���������ͨ��������Ũ���ᣬŨ�������������1.26g����ͨ�������ļ�ʯ�ң���ʯ�ҵ���������4.4g������B�ķ���ʽΪ �����䱽���ϵ�һ�����ֻ��һ�֣�����ϴ���������B�� �֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��C��H��O��Cl����Ԫ����ɣ�����Է�������Ϊ198.5��Cl�ڲ����ϣ���A��Cl2�ֱ���Fe���������������������ʵ���֮��Ϊ1��1��Ӧʱ���ֱ��DZ�����һ��ȡ�����������ֺͲ�����һ��ȡ��������һ�֣�A��NaHCO3��Һ��Ӧʱ������ų�����֪A�����з�Ӧ��������B��G��
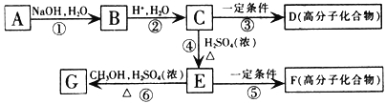
���㰴Ҫ��ش��������⣺
��1��A�Ļ�ѧʽΪ ��D�Ľṹ��ʽΪ ��
��2��������Ӧ������ȡ����Ӧ���� �����ţ���
��3��C�к��������ŵ����Ʒֱ�Ϊ ��
��4��E��ͬ���칹���У��������������������б�����������ֻ��һ���������Ҳ�����ֻ����һ��һCH3�����ܷ���������Ӧ�����������࣮��д��һ�ַ�����������E��ͬ���칹��Ľṹ��ʽ�� ��
��5��д������ָ����Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ����
A��NaOH�Ĵ���Һ���ȣ� ��
E��һ������������F�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com