

分析 (1)依据盖斯定律和热化学方程式计算得到;
(2)考虑影响反应速率的因素;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)?CH3OH(g)可知压强越大,越有利于平衡向正反应进行;
②由图1可知,在P1压强下,100℃时,CO的转化率为0.5,据此计算CO的浓度变化量,根据三段式计算平衡时各组分的平衡浓度,计算合成甲醇的化学平衡常数;
③在其它条件不变的情况下,向容器中通入CO、H2、CH3OH各0.5amol,等效减小氢气的浓度,平衡向逆反应移动;
(4)反应原理为二氧化硫、氧气和水反应生成硫酸,根据化合价变化判断负极物质,写出负极反应式;
②根据化合价变化判断阳极反应物质,写出阳极反应式;
(5)Na2SO3溶液的浓度为2×10-3mol/L,等体积混合后溶液中c(SO32-)=1×10-3mol/L,根据Ksp=c(SO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;阳极是亚硫酸氢根氧化成硫酸根,而阴极是水中的氢离子放电生成氢气,所以总的电解反应方程式为:2NaHSO3+H2O$\frac{\underline{\;电解\;}}{\;}$Na2SO3+H2SO4+H2↑.
解答 解:(1)用CO可以合成甲醇.已知:
①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ•mol-1;
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)?CH3OH(g)
△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为:-90.1;
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢,
故答案为:ac;
(3))①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)?CH3OH(g)可知压强越大,
越有利于平衡向正反应进行,故压强P1<P2,
故答案为:小于;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L) $\frac{a}{V}$ $\frac{2a}{V}$ 0
转化浓度(mol/L)$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
平衡浓度(mol/L)$\frac{a}{2V}$ $\frac{a}{V}$ $\frac{a}{2V}$
所以平衡常数K=$\frac{\frac{a}{2V}}{(\frac{a}{V})^{2}×\frac{a}{2V}}$=$(\frac{V}{a})^{2}$,
故答案为:$(\frac{V}{a})^{2}$;
③在其它条件不变的情况下,向容器中通入CO、H2、CH3OH各0.5amol,等效减小氢气的浓度,平衡向逆反应移动,
故答案为:向左;
(4))该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(5)Na2SO3溶液的浓度为2×10-3mol/L,等体积混合后溶液中c(SO32-)=$\frac{1}{2}$×2×10-3mol/L=1×10-3mol/L,根据Ksp=c(SO32-)•c(Ca2+)=3.1×10-7可知,c(Ca2+)=$\frac{3.1×1{0}^{-7}}{1×1{0}^{-3}}$mol/L=3.1×10-4mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为6.2×10-4mol/L,阳极是亚硫酸氢根氧化成硫酸根,而阴极是水中的氢离子放电生成氢气,所以总的电解反应方程式为:2NaHSO3+H2O$\frac{\underline{\;电解\;}}{\;}$Na2SO3+H2SO4+H2↑,
故答案为:6.2×10-4mol/L; 2NaHSO3+H2O$\frac{\underline{\;电解\;}}{\;}$Na2SO3+H2SO4+H2↑.
点评 本题考查影响平衡的因素、化学平衡常数、化学平衡图象、反应热的计算、电极反应式的书写等,难度中等,从化合价角度判断电极发生反应的物质时关键.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作发酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制备:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3与食醋混用,产生CO2气体:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-.
H++SO32-.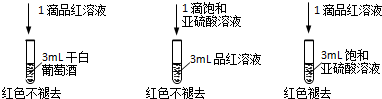
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com