
 2SO3(g),经一段时间后SO3的浓度增加了0.4mol?L-1,在这段时间内用O2表示的反应速率为0.4mol?L-1?s-1,则这段时间为()。
2SO3(g),经一段时间后SO3的浓度增加了0.4mol?L-1,在这段时间内用O2表示的反应速率为0.4mol?L-1?s-1,则这段时间为()。科目:高中化学 来源: 题型:
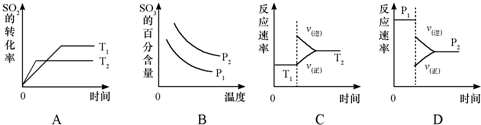
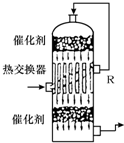 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
| ||
| ||
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
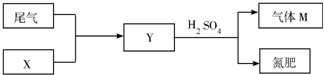
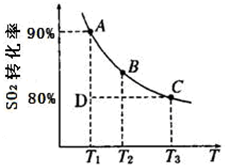 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com