
| A. | Al | B. | Fe2O3 | C. | Ca(HCO3)2 | D. | Al(OH)3 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定没有N2,HCl 和CO中至少有一种 | |
| B. | 一定有N2,HCl 和CO | |
| C. | 一定有N2HCl 和CO中至少有一种 | |
| D. | 一定有N2 和HCl,没有CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
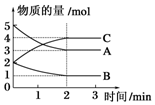 在2L固定容积的密闭容器中,在不同反应时间各物质的物质的量的变化情况如图所示.
在2L固定容积的密闭容器中,在不同反应时间各物质的物质的量的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是纯净物,氢氧化铁胶体带正电 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 胶体属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )
如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为2CH2=CH2+O2→2CH3CHO;下列说法错误的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 molol O2反应,则溶液中迁移0.4 mol e- | |
| C. | 负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| D. | 正极区溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为1.1NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 2.3 g金属钠与O2完全反应,转移电子的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
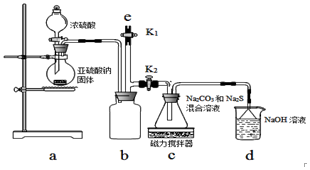 氰化钠是一种重要的基本化工原料.泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
氰化钠是一种重要的基本化工原料.泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com