
| A. | ①②④ | B. | ②④ | C. | ①③④ | D. | ③④ |
分析 ①通入氢气引入新的杂质;
②碳酸氢钠可与乙酸反应,除去乙酸,降低乙酸乙酯的溶解度;
③二氧化硫能与氢氧化钠反应;
④乙醇和水的沸点不同,水可与生石灰反应.
解答 解:①通入氢气引入新的杂质,氢气无法除掉,故①错误;
②碳酸氢钠可与乙酸反应,除去乙酸,降低乙酸乙酯的溶解度,则用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏可实现除杂,故②正确;
③二氧化硫能与氢氧化钠反应,二乙烯不能,可除杂,故③正确;
④乙醇和水的沸点不同,水可与生石灰反应,用蒸馏的方法分离,故④正确;
故选BD.
点评 本题考查物质的分离、提纯,为考查常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新的杂质,且不能影响被提纯物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
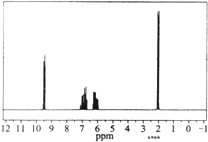
| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
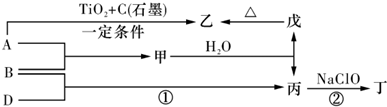
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
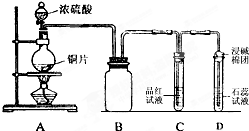 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
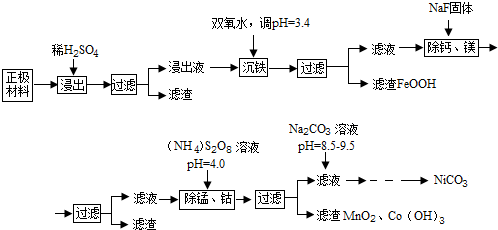
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com