
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| D. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 |
分析 检验溶液中是否含Cl-,与硝酸银生成白色沉淀AgCl,AgCl不溶于硝酸,以此来解答.
解答 解:A.取样,滴加AgNO3溶液,可能生成碳酸银白色沉淀,故A不选;
B.取样,先加盐酸酸化,引入氯离子,不能检验,故B不选;
C.取样,加少量AgNO3溶液,有白色沉淀,再加稀硝酸,看白色沉淀是否消失,若不消失,白色沉淀为AgCl,溶液中含有Cl-,故C选;
D.取样,先加稀硫酸酸化,再加入AgNO3溶液,可生成硫酸银白色沉淀,不能检验氯离子,故D不选;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象与结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.


科目:高中化学 来源: 题型:实验题
 我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:
我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
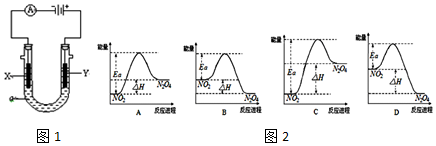
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
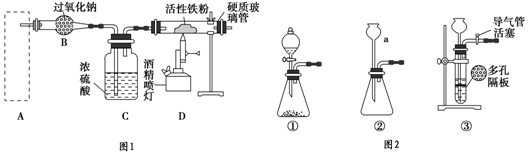
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
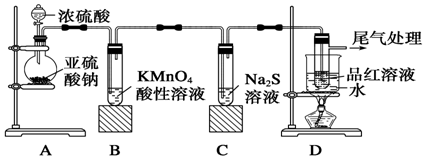
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的简单离子是其所在周期中元素的简单离子半径最小的 | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Y与W形成的化合物一定能使酸性高锰酸钾溶液腿色 | |
| D. | 最高价氧化物对应水化物的酸性X比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物LiAl具有强还原性,作负极材料 | |
| B. | 为了延长电池的使用寿命,可以隔一段时间添加含电解质的水溶液 | |
| C. | 放电时,该电池的总反应式为2Li+FeS═Li2S+Fe | |
| D. | 放电时,当电路中0.1mol电子的电量时,有0.1molLi+向LiAl移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com