
【题目】早在1998年,中国科学家便成功地在较低温度下制造出金刚石:CCl4+4Na![]() C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
(1)Ni原子价层电子的排布式为_______。元素C、Cl、Na中,第一电离能最大的是______________。
(2)石墨在高温高压下也可转变为金刚石。在石墨和金刚石中,C原子的杂化类型分别为_____________,熔点较高的是_____________,其原因为_______________。
(3)NH3易与Ni形成配合物 [Ni(NH3)6]SO4,该配合物中存在的化学键类型有_____________,其阴离子的空间构型为_____________。
(4)金属间化合物MgCNi3是一种新型超导体,呈钙钛矿构型,X射线衍射实验测得其晶胞参数为a=0.3812nm,其晶胞结构如图所示。晶胞中C位于Ni所形成的正八面体的体心,该正八面体的边长为___________nm。(![]() =1.414)
=1.414)
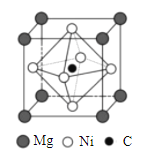
(5)在MgCNi3晶胞结构的另一种表示中,Mg处于体心位置,则C处于________________位置,Ni处于_______________位置。
【答案】3d84s2 Cl sp2、sp3 石墨 金刚石中只有碳碳σ键,石墨中除了碳碳σ键之外还有大π键,碳碳键长较短、键能较大 离子键、共价键(配位键) 正四面体 0.2695 顶角 棱心
【解析】
(1)Ni为28号元素,所以基态Ni原子的价层电子排布式为:3d84s2;
同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,元素C、Cl、Na中,第一电离能最大的是Cl;
(2)石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化;金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,碳原子的杂化类型为sp3杂化;熔点较高的是石墨,因为金刚石中只有碳碳σ键,石墨中除了碳碳σ键之外还有大π键,碳碳键长较短、键能较大;
(3)NH3易与Ni形成配合物 [Ni(NH3)6]SO4,该配合物中[Ni(NH3)6]2+与SO42-形成离子键,N与H、S与O之间形成共价键,以及Ni2+与NH3之间形成配位键,故存在的化学键类型有离子键、共价键(配位键);
[Ni(NH3)6]SO4中阴离子价层电子对个数=![]() =4且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子的立体构型为正四面体;
=4且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子的立体构型为正四面体;
(4)金属间化合物MgCNi3是一种新型超导体,呈钙钛矿构型,X射线衍射实验测得其晶胞参数为a=0.3812nm,其晶胞结构如图所示。晶胞中C位于Ni所形成的正八面体的体心,Ni在每个面的面心,则Ni与棱的距离为0.5a=0.1906nm,相邻两个Ni垂直于棱的交点和两个Ni形成等腰直角三角形,即该正八面体的边长为![]() ×0.5a=
×0.5a=![]() ×0.1906nm=0.2695nm;
×0.1906nm=0.2695nm;
(5)根据图中信息可知,若在MgCNi3晶胞结构的另一种表示中,Mg处于体心位置,则C处于顶角位置,Ni处于棱心位置。


科目:高中化学 来源: 题型:
【题目】增塑剂DCHP(F)是一种用于生产医疗器械和食品包装袋的原料,可以由芳香烃为原料制备而得:
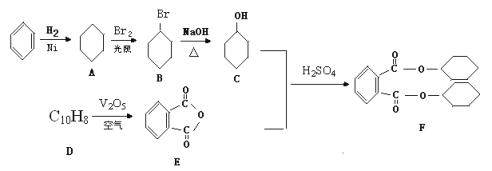
(1)D的结构简式是_________,D→E的反应类型为_______________。
(2)鉴别苯酚![]() 和化合物C
和化合物C![]() 的试剂为___________。
的试剂为___________。
(3)C的同系物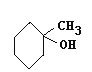 (G)根据系统命名法名称为____________,若化合物M是G的同分异构体,且分子中核磁共振氢谱显示有2个吸收峰(一氯代物只有两种),写出该化合物的结构简式是_________。(任写一种)
(G)根据系统命名法名称为____________,若化合物M是G的同分异构体,且分子中核磁共振氢谱显示有2个吸收峰(一氯代物只有两种),写出该化合物的结构简式是_________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 4NH3+5O2![]() 4NO+6H2O(g)在 5L 的密闭容器中进行,半分钟后,NO 的物质的量增 加了 0.3mol,则下列反应速率正确的是 ( )
4NO+6H2O(g)在 5L 的密闭容器中进行,半分钟后,NO 的物质的量增 加了 0.3mol,则下列反应速率正确的是 ( )
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.015 mol/(L·s) D. v(NH3)=0.002 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
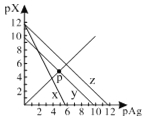
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应 温度,化学反应速率加快 |
B | 工业制硫酸过程中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 反应速率减慢 |
D | A.B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可 以改变化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如图:
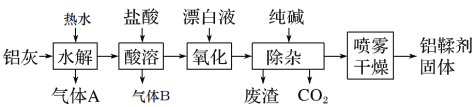
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90℃时水解生成A的化学方程式为:__,“水解”采用90℃而不在室温下进行的原因是___。
(2)“酸溶”时,生成气体B的离子方程式为___。
(3)“氧化”时反应的离子方程式为___。
(4)“除杂”中反应的离子方程式为__。
(5)“喷雾干燥”是将需干燥的物料,分散成很细的像雾一样的微粒,与热空气接触,在瞬间将大部分水分除去,使物料中的固体物质干燥成粉末。采用喷雾干燥而不用蒸发可有效防止产品的水解或分解,写出Al(OH)2Cl在较高温度下分解的化学方程式___。“喷雾干燥”中将需干燥的物料,分散成很细的微粒的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
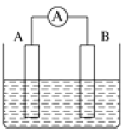
⑴将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是___________(填字母)。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:________________。
⑵若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:________________;该电池在工作时,A电极的质量将___________(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为____________。
⑶若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入C3H8和O2,该电池即为丙烷燃料电池,写出B电极反应式:_________________;A极的反应物C3H8的一氯代物有__________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中有毒气体处理为无毒气体。下图表示反应中的各种分子,其中不同的球表示不同种元素的原子。下列说法中,不正确的是 ( )
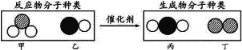
A. 乙、丙所含元素种类相同 B. 甲、丁中同种元素化合价不相等
C. 该反应中共有三种元素 D. 化学方程式中乙、丁的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2、CaC2都是离子化合物,都能与水反应放出气体。(Na2O2+2H2O=4NaOH+O2)它们( )
A.阴阳离子个数比均为![]() B.都含有非极性的共价键
B.都含有非极性的共价键
C.与水都发生氧化还原反应D.放出的都是可燃性气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com