��2012?˳������ģ��������ѧ��ѧ����Ԫ��ԭ�ӽṹ�����ʼ���;���±���
| ��� |
Ԫ�� |
�ṹ������ |
| �� |
A |
A�ĵ���������ˮ���ҷ�Ӧ������ǿ������Һ�к������ֵ�������ͬ������������ |
| �� |
B |
Bԭ���������������ڲ���������� |
| �� |
C |
C�����������������������Ϊ�ͻ���� |
| �� |
D |
A��D��E��ɵ�36���ӵĻ�������Ǽ�������������Ҫ�ɷ� |
| �� |
E |
ͨ������£�Eû�������ϼۣ�A��B��C��D��F������E�γɻ����� |
| �� |
F |
FԪ���������������۵Ĵ�����Ϊ4 |
���û�ѧ����ش��������⣺
��1����A��B��C˳������Ԫ�صĽ�������
����
����
����ԭ�ӽṹ������ԭ��
Na��Mg��Al���Ӳ�����ͬ���˵�����ĵ�����ԭ�Ӱ뾶��С��ԭ�Ӻ���������������ǿ�������Լ���
Na��Mg��Al���Ӳ�����ͬ���˵�����ĵ�����ԭ�Ӱ뾶��С��ԭ�Ӻ���������������ǿ�������Լ���
��
��2��һ�������£���4.0mol FE
2��3.0mol E
2 ͨ�뵽���Ϊ 2L���ܱ������У���Ӧ�ﵽƽ��ʱ��������ΪFE
2 0.4mol����˷�Ӧ��ƽ�ⳣ���ǣ��ı�������������ʹƽ��������Ӧ���������ƽ�ⳣ���������
ad
ad
������ĸ����
a������ѹǿ b�������¶� c��ʹ�ô��� d������Ӧ���Ũ��
��3��E����Ԫ�ؿ����γ�ԭ�Ӹ����ȷֱ�Ϊ1��2��1��1�����ֻ�����X��Y��
| ʵ���� |
�¶�/�� |
�����Լ� |
����Y���� |
| �� |
5 |
2�� 1mol/L FeCl3��Һ |
4mL 10% ��Y��Һ |
| �� |
40 |
2��1mol/L FeCl3��Һ |
4mL 10% ��Y��Һ |
| �� |
40 |
2��1mol/L FeCl3��Һ
2mL X |
|
��̽���¶ȶ�Y�ֽ����ʵ�Ӱ�죬Ӧѡ��
�٢�
�٢�
��ʵ�飻��̽��Y��Ũ�ȶԷֽ����ʵ�Ӱ�죬����д������ݣ�
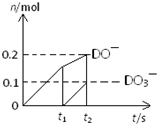
��4��һ������ʯ������ͨ��һ������D���ʣ�����ǡ����ȫ��Ӧ���������������ֺ�DԪ�ص����ӣ������������ӵ����ʵ�����n���뷴Ӧʱ�䣨t����������ͼ��ʾ����t
2ʱ������������������Ϊ
37g
37g
g����ʱ��Ӧ�ķ���ʽΪ
10Cl2+10Ca��OH��2=7CaCl2+2Ca��ClO��2+Ca��ClO3��2+10H2O
10Cl2+10Ca��OH��2=7CaCl2+2Ca��ClO��2+Ca��ClO3��2+10H2O
��



 ��У����ϵ�д�
��У����ϵ�д�






 CO(g)+3H2(g)������
CO(g)+3H2(g)������ 
 CH3OH(g)����H<0������
CH3OH(g)����H<0������