

分析 辉铜矿通入氧气充分煅烧,生成二氧化硫气体和固体CuO、Fe3O4,加入盐酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,[Cu(NH3)4]2+经加热可得到CuO,加入硫酸得到硫酸铜溶液,经蒸发浓缩、冷却结晶后可得到硫酸铜晶体,
(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;根据浓硫酸氧化Fe2+反应会生成对环境有污染的SO2;
(3)根据三价铁与KSCN溶液出现血红色,证明Fe3+是否完全除尽;根据溶液的组成判断滤液G的主要溶质;
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干.
(5)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,写出离子方程式;据比例关系4CuSO4•5H2O~4Cu2+~2I2~4S2O32-计算.
解答 解:辉铜矿通入氧气充分煅烧,生成二氧化硫气体和固体CuO、Fe3O4,加入盐酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,[Cu(NH3)4]2+经加热可得到CuO,加入硫酸得到硫酸铜溶液,经蒸发浓缩、冷却结晶后可得到硫酸铜晶体,
(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫,方程式为:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2,所以气体X是SO2;
故答案为:SO2;Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;因为浓硫酸氧化Fe2+反应会生成对环境有污染的SO2,所以不用,
故答案为:溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;浓硫酸与Fe2+反应会生成对环境有污染的SO2;
(3)因为三价铁与KSCN溶液出现血红色,所以取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;因为溶液D中含有[Cu(NH3)4]2+和硫酸根,所以D转化生成CuO后,剩余的溶液中含有(NH4)2SO4;
故答案为:取少量D溶液于试管中,滴入KSCN溶液,若溶液未出现血红色,则证明Fe3+完全除尽;(NH4)2SO4;
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干,
故答案为:过滤、洗涤;
(5)①硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
②据比例关系4CuSO4•5H2O~4Cu2+~2I2~4S2O32-,
c×V×10-3mol c×V×10-3mol
试样中CuSO4•5H2O的质量分数为$\frac{c×V×10{\\;}^{-3}×250}{a}$×$\frac{100mL}{25mL}$×100%=$\frac{100cv}{a}$%,
故答案为:$\frac{100cv}{a}$%.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
 硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 g | B. | 10 g | C. | 11 g | D. | 12 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 有机物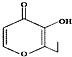 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 | |
| C. | 布洛芬结构如图所示 该物质可发生氧化、还原、加成、消去、取代反应 该物质可发生氧化、还原、加成、消去、取代反应 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA | |
| B. | 电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜 | |
| C. | 2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 品红溶液通入SO2气体后红色消失 | |
| B. | 显红色的酚酞溶液通入SO2后红色消失 | |
| C. | 酸性KMnO4溶液通入SO2后紫色消失 | |
| D. | 溴水通入SO2气体后橙色消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com