
| A. | 甲烷分子的球棍模型: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
分析 A、甲烷的球棍模型用小球和短棍表示,图示为甲烷的比例模型;
B、次氯酸的中心原子是氧原子,根据成键情况来书写结构式;
C、原子符号的左上角的数字是质量数,左下角的数字是质子数;
D、共价键在熔融状态下不能被破坏.
解答 解:A、 为甲烷的比例模型,甲烷的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型为: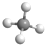 ,故A错误;
,故A错误;
B、次氯酸的中心原子是氧原子,结构式为H-O-Cl,故B错误;
C、质子数为53,中子数为78的碘原子的质量数为131,符号为:53131I,故C正确;
D、KHSO4属于离子化合物,由钾离子与硫酸氢根离子构成,熔融状态下的电离出钾离子与硫酸氢根离子,电离方程式为:KHSO4(熔融)=K++HSO4-,故D错误.
故选C.
点评 本题是对物质结构的考查,题目比较综合,涉及球棍模型、结构式的书写、原子的表示方法等,侧重考查学生对知识的迁移应用、分析解决问题的能力,注意对知识的全面掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀氨水和酚酞溶液 | B. | 滴有酚酞的Na2CO3溶液 | ||
| C. | 滴有酚酞的氢氧化钙溶液 | D. | 溶有SO2的品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红色的溶液中:Na+,K+,OH-,S2O${\;}_{3}^{2-}$ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH${\;}_{4}^{+}$,Fe2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$ | |
| C. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+,NO${\;}_{3}^{-}$,K+,F- | |
| D. | 含大量Cu2+的溶液中:NH${\;}_{4}^{+}$,Na+,Cl-,HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
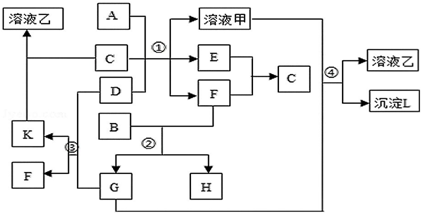
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com