
| A. | H2O2的电子式: | |
| B. | 铝离子的结构示意图: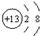 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
分析 A、双氧水为共价化合物;
B、铝离子是铝原子失去三个电子形成的;
C、质量数=质子数+中子数;
D、由同种元素形成的不同单质互为同素异形体.
解答 解:A、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故A错误;
,故A错误;
B、铝离子是铝原子失去三个电子形成的,故铝离子的结构示意图为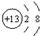 ,故B正确;
,故B正确;
C、质量数=质子数+中子数,故质子数为35、中子数为45的溴原子的质量数为80,故符号为8035Br,故C错误;
D、由同种元素形成的不同单质互为同素异形体,而146C与126C均为碳原子,不是单质,故不是同素异形体,故D错误.
故选B.
点评 本题考查了常见的化学用语,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
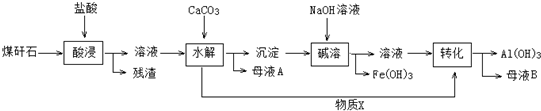
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | Al2(SO4)3═3SO42-+2Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 、
、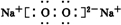 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
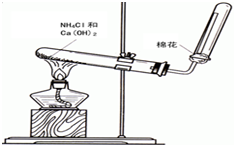 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下: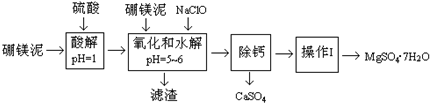
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. ,其名称为3-乙基戊烷.
,其名称为3-乙基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;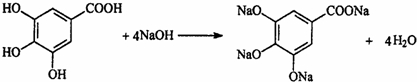 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com