
【题目】德国化学家哈伯因研制合成氨作出重大贡献而获得1918年诺贝尔化学奖,如今可以用电化学的方法合成氨,装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )

A. Pd电极b为阴极 B. 阴极的反应式为:N2+6H++6e-=2NH3
C. H+由阳极向阴极迁移 D. 陶瓷可以隔离N2和H2
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A. 常温常压下,48gO2含有的氧原子数为3NA
B. 1.7g NH3含有的质子数为NA
C. 标准状况下,11.2L氦气和氢气的混合气含有的分子数为0.5NA
D. 1L 0.1 mol/LCH3CH2OH水溶液中含H原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列有机物:
① CH2=CH2 ②![]()
③ CH3CH(OH)CH2CH3 ④ (CH3)2C=CH2
⑤ CH3CH2OCH2CH3 ⑥ CH3CH=CHCH=CHCOOH
(1)属于羧酸的是_____(填序号)。
(2)与③互为同分异构体的是_____(填序号)。
(3)与①互为同系物的是_____(填序号)。
(4)用系统命名法给④命名,其名称为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种常见有机物之间的转化关系,下列有关说法正确的是( )

A. 反应①、②、③、④均属于取代反应
B. 反应④的条件为:稀硫酸,加热
C. 与d含有相同官能团的e的同分异构体只有1种
D. a遇碘单质变蓝,b能与银氨溶液水浴加热条件下反应析出银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是石蜡油在炽热碎瓷片的作用下产生C2H4,并检验C2H4性质的实验,完成下列各题。
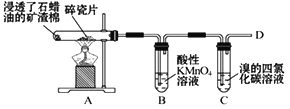
(1)B 中溶液褪色,原因是______________
(2)C 中反应的化学方程式为_____________
(3)在D 处点燃时必须进行的操作是___________,D 处反应的化学方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,工业大规模生产前,实验室先按如下流程进行模拟制备少量Mg(ClO3)2·6H2O:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。

(1)卤块中加H2O2的目的是________________,写出该反应的离子方程式__________________。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?_________________。
(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=___________(已知Ksp[Fe(OH)3=4×10-38],过滤所得滤渣的主要成分有______________。
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:___________,请利用该反应,结合上图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③___________;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要![]() NaOH溶液475mL和
NaOH溶液475mL和![]() 硫酸溶液
硫酸溶液![]() 根据这两种溶液的配制情况回答下列问题:
根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______![]() 填序号
填序号![]() ,配制上述溶液还需用到的玻璃仪器是______
,配制上述溶液还需用到的玻璃仪器是______![]() 填仪器名称
填仪器名称![]() .
.
(2)下列操作中,不能用容量瓶实现的有______![]() 填序号
填序号![]() .
.
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______![]() 在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______
在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______![]() 填”大于”、“等于”或“小于”,下同
填”大于”、“等于”或“小于”,下同![]() 若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______
若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______![]() .
.
(4)根据计算得知,所需质量分数为![]() 、密度为
、密度为![]() 的浓硫酸的体积为______
的浓硫酸的体积为______![]() 计算结果保留一位小数
计算结果保留一位小数![]() 如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
如果实验室有10mL、15mL、20mL、50mL量筒,选用______mL量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验中预计需要使用480mLamol/L的纯碱溶液,下面是某同学在实验室配制该溶液的流程图,回答下列问题:
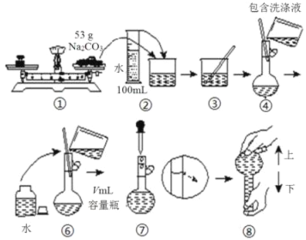
(1)流程图中的配制过程少了第⑤步,请指出缺少的步骤内容是_____________________________
(2)所选容量瓶最合适的v值为____________,根据图示的相关数据,可求出a=__________.容量瓶在使用之前必须进行的一项操作是________________________。
(3)所给出的流程图中体现出的操作内容有三个明显错误(其中不包括缺少的第⑤步),请写出:
①__________________________②________________________③__________________________。
(4)指出下列实验操作对结果以及对所配制溶液浓度的影响,填写“偏大”“偏小”或者“无影响”.
①溶解后,没有洗涤玻璃棒以及烧杯:_________________
②定容时俯视刻度线:_________________
③未经冷却趁热将溶液注入容量瓶中______________
④容量瓶洗涤后,未经干燥处理_______________
⑤摇匀后发现液面低于刻度线继续加水定容______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研与生活中有很重要的作用。回答下列问题:
(1)碘可用作心脏起搏器电源——锂碘电池的材料,则碘电极是电池的______(填“正”或“负”)极。
(2)“加碘食盐”中含有少量的KIO3,向其中加入亚硫酸氢钠溶液,能产生使淀粉变蓝的物质,则该反应中氧化剂与还原剂的物质的量之比是_______________。
(3)碘单质与氢气反应的能量变化过程如图所示:
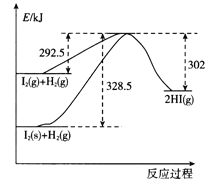
写出碘I2(s)转化成碘I2(g)的热化学方程式:__________________________________。
(4)在合成氨工业中用I2O5来测定CO的含量:5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s),在装有足量的I2O5固体的2L恒容密闭容器中通入2molCO发生上述反应,测得温度T1、T2下,一氧化碳的体积分数
5CO2(g)+I2(s),在装有足量的I2O5固体的2L恒容密闭容器中通入2molCO发生上述反应,测得温度T1、T2下,一氧化碳的体积分数![]() (CO)随时间t的变化曲线如图所示。回答下列问题:
(CO)随时间t的变化曲线如图所示。回答下列问题:

①温度T1下的平衡转化率![]() =________%,b点的平衡常数K2=__________。
=________%,b点的平衡常数K2=__________。
②在温度T2下,反应达到平衡后再充入适量的CO,重新达到平衡时;CO气体的转化率将_______(填“变大”“变小”或“不变”),该反应的△H_____(填“>”“<"或“=”)0。
③下列各种措施能提高该反应的CO转化率的是____________。
A.升温 B.加压 C.添加催化剂 D.移走部分CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com