
【题目】(1)碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是___________(填序号)。
(2)下列离子晶体的立体构型示意图,如下图所示。

以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:_____________。
(3)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是______________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
【答案】③④①②⑥⑤ MN MN2 MN2 MN 离子键、非极性共价键 ![]()
【解析】
(1)熔点的一般规律:原子晶体>离子晶体>分子晶体,同种晶体根据晶体中微粒间的作用力大小分析;
(2)根据微粒所在晶胞位置,利用均摊法计算微粒数目之比,得到化学式;
(3)①根据FeS2晶体的晶体结构可知,晶体中阳离子与阴离子个数比为为1:1,所以晶体中存在亚铁离子与S22-,据此判断化学键;
②晶体结构A中相邻的阴、阳离子间的距离为a cm,所以晶胞的体积为a3cm3,晶胞中含有阴阳离子个数都是1/2,根据ρ=m/V算密度。
(1)晶体属于原子晶体的有①③④、离子晶体的有②、分子晶体的有⑤⑥.一般来说,原子晶体的熔点>离子晶体的熔点>分子晶体的熔点;对于原子晶体,原子半径越大,键长越长,键能越小,熔点越低,键长Si-Si>Si-C>C-C,相应键能Si-Si<Si-C<C-C,故它们的熔点:金刚石>碳化硅>晶体硅;分子晶体中有氢键的熔点较高,所以熔点:冰>干冰,所以它们的熔点由高到低的顺序是③④①②⑥⑤,故答案为:③④①②⑥⑤。
(2)A.M位于顶点,数目为4×1/8=1/2,N位于顶点,数目为4×1/8=1/2,微粒数目为1:1,即化学式为MN;
B.M分别位于晶胞的体心和顶点位置,体心占1个,顶点占8×1/8=1个,共2个,N分别位于面上和体内,面上4×1/2=2个,体内2个,共4个,即晶胞中两种微粒数目之比为1:2,化学式为MN2;
C.M位于顶点,数目为4×1/8=1/2,N位于体心,数目为1,化学式为MN2;
D.M位于顶点,数目为8×1/8=1,N位于体心,数目为1,化学式为MN,
故答案为:MN;MN2;MN2;MN。
(3)①根据FeS2晶体的晶体结构可知,晶体中阳离子与阴离子个数比为为1:1,所以晶体中存在亚铁离子与S22-,亚铁离子与S22-之间是离子键,S22-中存在非极性共价键,所以晶体中存离子键和(非极性)共价键,故答案为:离子键和(非极性)共价键。
②晶体结构A中相邻的阴、阳离子间的距离为a cm,所以晶胞的体积为a3cm3,晶胞中含有阴阳离子个数都是1/2,所以晶体的密度为ρ= g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.Al、SiO2、Ca(OH)2、NaHCO3等既能与盐酸反应,又能与氢氧化钠溶液反应
B.若a、b、c分別为Si、SiO2、H2SiO3,则可以通过一步反应实现如图所示的转化关系
C.Fe2O3![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)![]() 无水Fe2(SO4)3
无水Fe2(SO4)3
D.Na![]() Na2O2
Na2O2![]() NaI
NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工农业生产中具有广泛应用。
请回答下列问题:
(1)基态B原子的价电子排布图___,B属于元素周期表中的___区元素。
(2)NaBO2可用于织物漂白。
①第二周期中第一电离能介于B和O之间的元素为___(填元素符号)。
②BO2-的空间构型为____,写出两种与其互为等电子体的分子的化学式:____。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为_____、____。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为______。
(5)一种新型轻质储氢材料的晶胞结构如图所示:
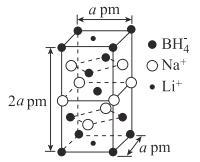
①该化合物的化学式为____。
②设阿伏加德罗常数的值为NA,该晶体的密度为___g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液” 通常稀释100倍(体积之比)后使用。请回答下列问题:
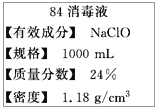
(1)此“84消毒液”的物质的量浓度约为________mol/L。(计算结果保留一位小数)
(2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=__mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是_____(填仪器序号),还缺少的玻璃仪器是______。
A![]() B
B![]() C
C![]() D
D E
E![]()
②下列操作中,容量瓶不具备的功能是__________(填序号)。
a.配制一定体积准确浓度的标准溶液
b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液
d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
③容量瓶上需标有以下五项中的________。
a温度 b浓度 c容量 d压强 e刻度线
④请计算该同学配制此溶液需称取称量NaClO固体的质量为________g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是_________。(填序号)。
A.定容时俯视刻度线
B.转移前,容量瓶内有蒸馏水
C.未冷至室温就转移定容
D.定容时水多用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出24号元素Cr的基态原子的电子排布式____________。
(2)元素e的基态原子的电子排布图:_______________。
(3)c有_____种运动不同的电子
(4)比较g、h、i三种元素的第一电离能的大小顺序:_______________(按由大到小的顺序排列,用元素符号表示)。
(5)图中o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________。
(6)第3周期主族元素按单质熔点高低的顺序如图所示,横坐标序号“8”代表______(填元素符号,下同)其中电负性最大的是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆 开)1mol 化学键时释放(或吸收)的能量。已知白磷和![]() 的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应
的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应![]() 表述正确的是 ( )
表述正确的是 ( )

A.放出1638 kJ 的热量B.吸收1638 kJ 的热量
C.放出126 kJ 的热量D.吸收126 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应![]() 在 5 L 密闭容器中进行,10s 后
在 5 L 密闭容器中进行,10s 后![]() 的物质的量增加了 0.60 mol,则 10s 内反应的平均速率
的物质的量增加了 0.60 mol,则 10s 内反应的平均速率![]() (X)可表示为( )
(X)可表示为( )
A.![]() (
(![]() )=0.06 mol/(L·min)B.
)=0.06 mol/(L·min)B.![]() (
(![]() )=0.008 mol/(L·s)
)=0.008 mol/(L·s)
C.![]() (
(![]() )=0.006 mol/(L·s)D.
)=0.006 mol/(L·s)D.![]() (NO)=0.04 mol/(L·s)
(NO)=0.04 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B. 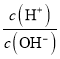 =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 17 g羟基(—OH)所含有的电子数是10NA个
B. 1 mol苯乙烯中含有的碳碳双键数为4NA个
C. 常温下,14 g乙烯和丙烯的混合物中总原子数为3NA个
D. 4.2 g C3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com