
����Ŀ��2015��8��12�������ش�ը�¹ʣ���һ�����������ǶԻ�������Ĺ�ע���ݲ�Σ���ֿ��д��д������ơ��ء����ף�P4��������狀��軯�ƣ�NaCN����
��1�������ж��ܺ�������Һ����������ԭ��Ӧ��3P4+10HClO3+18H2O=10HCl+12H3PO4 �� �÷�Ӧ������������ �� ����1mol P4�μӷ�Ӧת�Ƶ���Ϊ mol��
��2���軯�ƣ�NaCN����һ�ֻ���ԭ�ϣ����ڻ�����ѧ�ϳɡ���ơ�ұ����л��ϳ�ҽҩ��ũҩ�����������ȷ��森
����֪��25��ʱ��HCN�ĵ���ƽ�ⳣ��Ka=6.2��10��10 �� H2CO3��25��ʱ�ĵ���ƽ�ⳣ����Ka1=4.5��10��7��
Ka2=4.7��10��11 �� ���� NaCN��Һͨ������CO2��Ӧ����ʽ�ǣ� ��
�ڳ����£��軯���������������Һ��Ӧ������̼�����ƺ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬����䶾�ԣ��÷�Ӧ�Ļ�ѧ����ʽ�ǣ� ��
�۵�ⷨ���Դ��������еĵ����������ͼʾ���أ���NOx�ڵ����зֽ������Ⱦ��N2��O2��ȥ�����缫���ǹ������������ʣ���һ�������¿����ɴ���O2��������������ӦΪ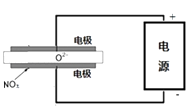
��3���ٴ�ͳ��ҵ�����ð������Ժϳ����أ���Ҫ��Ӧ���£�
2NH3��g��+CO2��g��=NH2CO2NH4��s����H=��159.47kJmol��1
NH2CO2NH4��s��=CO��NH2��2��s��+H2O��g����H=+72.49kJmol��1
��Ӧ2NH3��g��++CO2��g��=CO��NH2����s��+H2O��g���ġ�H=kJmol��1
�ڹ�ҵ���ð����Ʊ����ᣬ��һ�����������ۼ��뵽100mLijŨ�ȵ�ϡ�����г�ַ�Ӧ��������ʣ��m1g���ۣ���ʱ���ռ���NO����448mL����״������Ȼ��������������м���ϡ���������ٲ���NOΪֹ������ʣ������m2g����m1��m2Ϊ �� ��������Ϊͭ������Ӧ������
���𰸡�
��1��H3PO4��20
��2��CO2+NaCN+H2O=NaHCO3+HCN��NaCN+H2O2+H2O=NaHCO3+NH3����2NOx+4xe��=N2+2xO2��
��3����86.98��5.04
���������⣺��1����Ӧ��PԪ�ػ��ϼ����ߵõ�H3PO4 �� ��������ΪH3PO4 �� ����1mol P4�μӷ�Ӧת�Ƶ���Ϊ1mol��4��5=20mol�����Դ��ǣ�H3PO4��20��
��2.�����ɵ���ƽ�ⳣ����֪�����ԣ�H2CO3��HCN��HCO3�� �� ��NaCN��Һͨ������CO2����NaHCO3��HCN����Ӧ����ʽΪ��CO2+NaCN+H2O=NaHCO3+HCN��
���Դ��ǣ�CO2+NaCN+H2O=NaHCO3+HCN��
�ڳ����£��軯���������������Һ��Ӧ������̼�����ƺ���ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬������Ϊ��������Ӧ����ʽΪ��NaCN+H2O2+H2O=NaHCO3+NH3����
���Դ��ǣ�NaCN+H2O2+H2O=NaHCO3+NH3����
�۵�������������ԭ��Ӧ��NOx��������õ�������N2��O2�� �� �����缫��ӦʽΪ��2NOx+4xe��=N2+2xO2�� ��
���Դ��ǣ�2NOx+4xe��=N2+2xO2��
��3.������֪����.2NH3��g��+CO2��g���TNH2CO2NH4��s����H=��159.47kJmol��1
��NH2CO2NH4��s���TCO��NH2��2��s��+H2O��g����H=+72.49kJmol��1
���ݸ�˹���ɣ���+��ɵã�2NH3��g��+CO2��g���TCO��NH2����s��+H2O��g������H=��159.47kJmol��1+72.49kJmol��1=��86.98kJmol��1 ��
���Դ��ǣ���86.98��
�����ۼ��뵽100mLijŨ�ȵ�ϡ�����У���ַ�Ӧ��������ʣ��m1g���ۣ�����Fe��NO3��2��NO���壬NO�����ʵ���Ϊ ![]() =0.02mol�����ݵ���ת���غ��֪���μӷ�Ӧ��Fe�����ʵ���Ϊ
=0.02mol�����ݵ���ת���غ��֪���μӷ�Ӧ��Fe�����ʵ���Ϊ ![]() =0.03mol������Feԭ���غ��֪����Һ��n[Fe��NO3��2]=0.03mol����Һ��n��NO3����=0.06mol��
=0.03mol������Feԭ���غ��֪����Һ��n[Fe��NO3��2]=0.03mol����Һ��n��NO3����=0.06mol��
������Һ������ϡ���������ٷ�ӦΪֹ��Fe��NO3��2��NO3��������Ӧ3Fe+8H++2NO3���T3Fe2++2NO��+4H2O������ʣ��ͭ��m2g����m1��m2��Ϊ����Һ��NO3����Ӧ��ͭ�����������ٴη�Ӧ��ͭ�����ʵ���Ϊxmol����
3Fe | + | 8H+ | + | 2NO3�� | �T | 3Fe2+ | + | 2NO�� | + | 4H2O |
3 | 2 |
����x=0.09mol
�����ٴη�Ӧ��Fe������Ϊ0.09mol��56g/mol=5.04g������m1��m2��=5.04g��
���Դ��ǣ�5.04��
�����㾫����������Ĺؼ������������������ˮ��Һ�еĵ���ƽ������֪ʶ�����յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��ز��������ı���ԭ���ǣ� ��
A. ԭ�������Һ�ܵ���������ƶ�������
B. ���������߽�������Բ�ͬ�ĵ缫����
C. �缫�Ͻ��е�������ԭ��Ӧ��������Ϊ����
D. �缫�Ͻ��е�������ԭ��Ӧ�л��е��ӵ�ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѡ����ʵķ��뷽�����ں����ϡ�
A.��ȡ��B.��Һ��C.����D.����
(1)���뱥��ʳ��ˮ��ɳ�ӵĻ����___��
(2)����ˮ�����͵Ļ����___��
(3)�������Ȼ�̼(�е�Ϊ76.75 ��)�ͼױ�(�е�Ϊ110.6 ��)�Ļ����___��
(4)�ӵ��ˮ��Һ����ȡ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ���������һ�ֻ�����Һ�������˳���Һ���Ի��ǣ������ʵ��װ�÷���©�����û��ˮ����ֽҲδ���������С©���������ʵ��ʧ�ܵ�ԭ����������в����еģ�������
A. ��ֽ�߳�©����Ե�IJ���δ���� B. ��ֽ��©��֮��������δ���ŵ�
C. �㵹Һ��ʱҺ�������ֽ��Ե D. ����ʱ����������һ����ֽһ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����λ������������У�����ȷ����( )
A.��λ�������бض�������λ��
B.��λ��������ֻ����λ��
C.[Cu(H2O)4]2���е�Cu2���ṩ�չ����H2O�е�Oԭ���ṩ�¶Ե��ӣ����߽���γ���λ��
D.��λ�������ڰ뵼��ȼ�˼�����ҽѧ��ѧ������Ӧ�Ͳ��ϻ�ѧ�������й㷺��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ѧ��Ӧ�У�����Ԫ�ر�����������ԭ���Ȳ��������ֲ�����ԭ��˳�����У���ȷ���ǣ�������
��N2+O2 ![]() 2NO
2NO
��4AgNO3 ![]() 2Ag2O+4NO2��+O2��
2Ag2O+4NO2��+O2��
��2NH4Cl+Ba��OH��2 ![]() BaCl2+2NH3��+2H2O��
BaCl2+2NH3��+2H2O��
A.�٢ڢ�
B.�ڢ٢�
C.�ۢڢ�
D.�ۢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ƿ�����ȵ����壬��ͬ��ͬѹʱƿ������Ĺ�ϵһ����ȷ���ǣ�������
A.����ԭ�������
B.�����ܶ����
C.�����������
D.Ħ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ����ȫ��������������������������ǿ������ǿ������������̭�Ʊ공���Ͼɳ������������ʲ����ڿ�����Ⱦ����ǣ� ��
A.CO2
B.SO2
C.NO2
D.PM2.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�ͬʱ�����ȷ��ӡ������Ӻ��ȵĺ�����������ǣ� ��
A.Һ��B.��ˮC.�����D.�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com