
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
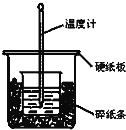
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
【答案】环形玻璃搅拌棒 偏小 相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关 HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣51.8 kJ/mol
【解析】
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是用于搅拌的环形玻璃搅拌棒;
(2)大烧杯上如果不盖硬纸板,会导致热量散失,测得的温差会比真实值小,求得的中和热数值偏小;
(3)中和热是指酸跟碱发生中和反应生成1molH2O(l)所放出的能量,与酸碱的用量无关,所以求得的中和热数值相等;
(4))三次平行操作测得终止温度与起始温度差(t2-t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,由于第②组数据与其他两组相差较大,将第②组舍去,温度差的平均值为3.1℃,50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.1℃=1259.8J,即1.2598kJ,所以实验测得的中和热![]() ,该反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8kJ/mol。
,该反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8kJ/mol。


科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式或离子方程式。
(1)H2O2将碱性工业废水中的CN-氧化为碳酸盐和氨气的离子方程式:____________。
(2)硫化氢具有还原性,可以和许多氧化剂反应。在硫酸溶液中,H2S和KMnO4反应生成S、MnSO4、K2SO4和 H2O,写出该反应的化学方程式:________。
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的离子方程式:__。
(4)FeCl3与KClO在强碱性条件下反应可生成K2FeO4和KCl,写出该反应的离子方程式:____。
(5)催化反硝化法中,H2能将![]() 还原为N2,反应进行一段时间后溶液呈碱性,写出该反应的离子方程式:________。
还原为N2,反应进行一段时间后溶液呈碱性,写出该反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期主族元素,Y的原子序数是W和Z的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水中不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌.下列说法正确的是
A.四种元素原子中,原子半径最大的是Z
B.X、Y形成的化合物能溶于盐酸
C.最高价氧化物对应水化物的酸性:Z强于Y
D.1molW单质与足量X单质反应,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) ![]() 2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:

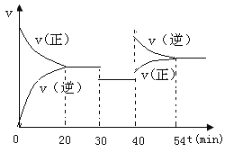
(1)0~20min,A的平均反应速率为_________________;8min时,v(正)___v(逆)(填:>、=或<)
(2)反应方程式中的x=_______,30min时改变的反应条件是________________________。
(3)20~30min时反应的平衡常数_______30~40min时反应的平衡常数(填:>、=或<)。
(4)该反应的正反应为________(填:“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是__________________min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
(1)H元素在周期表中属于 ______ 区.G的基态原子电子排布式为 ______ CD2+中C的杂化类型是 ______
(2)下列说法不正确的是 ______ .
a.B2A2分子中含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.A2D2分子的空间构型为直线形 d.B、C、D的电负性由大到小的顺序为D>C>B
e.B、C、D的第一电离能由大到小的顺序为D>C>B
f.H2+能与BD分子形成[H(BD)]2+,其原因是BD分子中含有空轨道
g.B和G的单质能形成相同类型的晶体,其熔点B>G
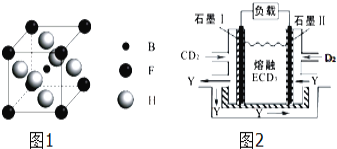
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中.晶胞如图1所示,该晶体的化学式为 ______
(4)CD2、D2和熔融ECD3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、能源、环境等密切相关。下列叙述正确的是( )
A.油脂和蛋白质是人体必需的营养物质,都属于高分子化合物
B.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质
C.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
D.中医古籍![]() 肘后备急方
肘后备急方![]() 中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化
中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示装置制取(必要时可加热)、净化、收集的气体是
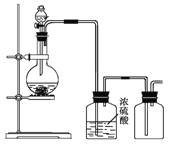
A.亚硫酸钠固体与硫酸反应制二氧化硫
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.铜与稀硝酸反应制一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
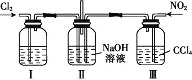
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com