
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
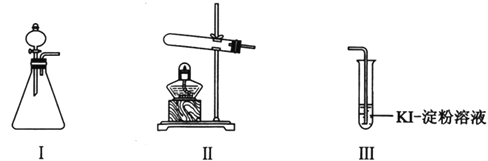
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
【答案】 MnO2固体 分液漏斗 O2+4I-+4H+=2I2+2H2O 酸性环境 使用不同浓度的稀硫酸作对比实验 AD 3I2+6OH-=5I-+IO3-+3H2O 在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误。
【解析】(1)根据实验的目的,结合可供选择的试剂,甲同学实验中的现象为I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝,需要向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,故答案为:MnO2固体;分液漏斗;
(2)根据丙实验的现象,Ⅲ中有气泡冒出,溶液变蓝,说明O2与KI溶液反应生成了碘单质,反应的离子方程式为O2+4I-+4H+=2I2+2H2O,故答案为:O2+4I-+4H+=2I2+2H2O;
(3)对比乙、丙实验可知,淀粉溶液不变蓝色的区别是溶液的酸碱性不同造成的,因此O2与KI溶液发生反应的适宜条件是酸性环境。为进一步探究该条件对反应速率的影响,可以使用不同浓度的稀硫酸作对比实验,故答案为:酸性环境; 使用不同浓度的稀硫酸作对比实验;
(4)A.过氧化氢具有还原性,氧气没有,若酸性 KMnO4溶液褪色,则可以证明白雾中含有H2O2,正确;B. 氧气和过氧化氢都能将FeCl2 氧化,现象相同,不能证明白雾中含有H2O2,错误;C. 氧气和过氧化氢都能将Na2S 氧化,现象相同,不能证明白雾中含有H2O2,错误; D.氧气不能使品红褪色,过氧化氢具有强氧化性,能够将品红漂白褪色,可以证明白雾中含有H2O2,正确;故选AD;
(5)KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。碘可以与生成的氢氧化钾反应,离子方程式为3I2+6OH-=5I-+IO3-+3H2O,没有了碘单质,淀粉溶液不会变蓝;I-和IO3-在酸性条件下可以反应生成碘单质,因此在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误,故答案为:3I2+6OH-=5I-+IO3-+3H2O; 在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某化学活动小组利用如图装置对电化学进行探究,开始两电极质量相等,下列说法正确的是( )
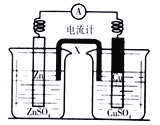
A. 若X为铜片,左池发生吸氧腐蚀作原电池,X在右池的电极反应式为Cu-2e-=Cu2+
B. 若X装载的是足量饱和KCl溶液浸泡的琼脂,当外电路通过0.02mol电子时,两电极的质量差为0.64g
C. 若X装载的是足量饱和KC1洛液浸泡的琼脂,则X中的K+移向左池
D. 若X为锌片,左池为电池的负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式2H2(气) + O2(气) = 2H2O(气) + 483.6 kJ/mol ,化学计量(系数)表示的是
A. 体积数 B. 物质和质量 C. 物质的量 D. 物质的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)。
(2)请用单向桥表示反应①的电子转移的方向和数目:________________。其中,该反应的氧化产物是___________,还原产物是__________。
(3)反应③的离子反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列是A、B、C、D、E五种短周期元素的某些性质:
性质 | A | B | C | D | E |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是____(填序号)。
a.![]() b.CH4 c.CH2
b.CH4 c.CH2![]() CHCH3d.CH3CH2C≡CH e.CH3CH3
CHCH3d.CH3CH2C≡CH e.CH3CH3
(2)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______(写化学式)
(3)B、D形成的简单氢化物,沸点:_______更高(写化学式)
II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是_______。
(2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__。
(3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。

试剂a是____;分离方法③是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构模型的演变图如右,下列符合历史演变顺序的一组排列是

A. (1)(3)(2)(4) B. (1)(2)(3)(4)
C. (1)(4)(3)(2) D. (1)(3)(4)(2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com