
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是
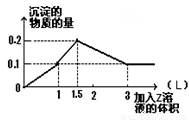
A.氯化铝、氯化镁、氢氧化钠 B.偏铝酸钠、氢氧化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠 D.偏铝酸钠、氯化钡、硫酸
B
【解析】
试题分析:由图像判断,沉淀部分溶于Z溶液,说明该沉淀中可能含有氢氧化铝,Z是氢氧化钠,或者沉淀中有碱性沉淀,Z是强酸溶液,且沉淀中含有不溶于酸的物质。若沉淀中含有氢氧化铝,则X、Y中有一种物质中含有铝离子,1L0.1mol/L的溶液中含有0.1mol铝离子完全沉淀,需要0.1 mol·L—1氢氧化钠溶液的体积是3L,而图像中沉淀达到最大值时才消耗1.5LZ,所以与图像不符,排除A、C;B、D选项中均含有偏铝酸钠,则0.1mol偏铝酸钠完全沉淀需要0.1mol氢离子,需要0.1mol/L硫酸的体积是0.5L,若含有氯化钡溶液,则0.1mol氯化钡与0.1mol硫酸完全反应生成硫酸钡沉淀,需要硫酸的体积是1L,则沉淀达到最大值时消耗的硫酸的体积是1L,而不是1.5L,图像的前半部分不符,所以不可能含有氯化钡。若含有氢氧化钡,则0.1mol氢氧化钡恰好与1L0.1mol/L的硫酸反应生成0.1mol硫酸钡沉淀和水,偏铝酸钠与0.5L硫酸反应生成0.1mol氢氧化铝沉淀,再与1.5L的硫酸反应氢氧化铝沉淀全部溶解,与图像相符,则答案选B。
考点:考查铝盐、偏铝酸盐与酸、碱的反应图像的分析


科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
2013年10月24日在京沪高速公路扬州境内高邮段发生了一起重大交通事故,是由于大雾引起的汽车追尾。雾属于下列哪种分散系
A.乳浊液 B.溶液 C.胶体 D.悬浊液
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
(8分)(混合物平均摩尔质量通常可表示为: ,用此概念可以讨论许多化学问题:
,用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度____(选填“>”、“<”或“=”)干燥空气的密度,理由是_____________;
(2)在一定条件下的密闭容器中,以碳和水蒸气为反应物,发生反应:C(s)+H2O(g) CO(g)+H2(g);达到平衡后保持温度不变并加压,则
CO(g)+H2(g);达到平衡后保持温度不变并加压,则 (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”);
(3)以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n (SO2)=____________mol(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3?H2O AlO2-+ 4NH4+ + 2H2O
B.澄清石灰水与少量苏打溶液混合:Ca2+ + OH-+ HCO3- CaCO3↓+ H2O
C.碳酸钙溶于醋酸CaCO3 + 2H+ Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++ Cl2 2Fe3+ +2Cl-
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:简答题
某溶液的溶质是由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、CO32-、AlO2-、SO32-、SO42-。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 ;
(2)沉淀丙中一定含有 ,可能含有 。
(3)该溶液中肯定存在的离子有 。
(4)气体甲的化学式为 ;气体乙的名称为 ;气体丙的分子几何构型是 ;
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中发生的离子方程式为 ; 。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取:采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
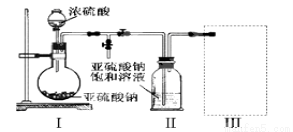
(1)装置Ⅰ中产生气体的化学方程式为 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
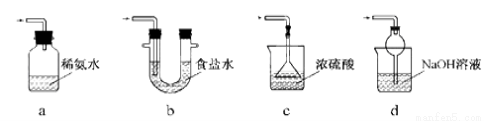
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是
(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三 葡萄酒中抗氧化剂残留量的测定
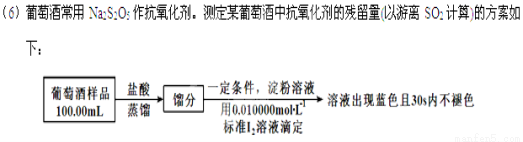
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
在FeCl3,CuCl2,FeCl2的混合溶液中,Fe3+,Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
A.2∶1 B.1∶2 C.1∶3 D.1∶4
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(14分)有机物A((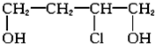 ))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
))是合成高分子化合物HPMA的中间体,HPMA可用于制备锅炉阻垢剂。关于A有如下反应流程:
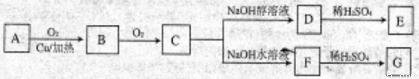
请回答下列问题:
(1)有机物A不能够发生的反应有:_________(填写字母)
A. 取代反应 B. 加成反应 C. 消去反应 D. 酯化反应
(2)可与1mol 有机物C反应的NaOH的物质的量最多可为___________
A. 1mol B. 2mol C. 3mol D. 4mol
(3)1mol A与E可在浓硫酸作用下脱去2mol H2O,写出该反应的化学方程式:________________;
(4)E在高温、高压和催化剂作用下反应生成高分子化合物HPMA,写出该反应的化学方程式:________;
(5)H是G的一种同分异构体。0.1mol H与足量金属Na反应放出3.36L氢气(标准状况下),0.1mol H足量NaHCO3反应放出2.24LCO2(标准状况下),H能发生银镜反应。H的结构简式可能是:____________、________________.
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是 ( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com