
| A. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 短周期元素正化合价数值和其族序数相同 | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |
分析 A、氢化物的酸性不能比较非金属性强弱;
B、优良的催化剂和耐高温、耐腐蚀的合金材料大多属于过渡元素;
C、最高正化合价等于其族序数;
D、电子层结构相同的阴阳离子,阳离子的核电荷数大于阴离子,电子层相同核电荷数越多半径越大.
解答 解:A、氢化物的酸性不能比较非金属性强弱,非金属性F>Cl,故A正确;
B、优良的催化剂和耐高温、耐腐蚀的合金材料大多属于过渡元素,故B正确;
C、短周期元素正化合价数值与其族序数无关,如次氯酸中的氯元素为+1价,而族序数为7,故C错误;
D、周期元素形成的微粒X2-与 Y2+核外电子排布相同,所以离子半径:X2->Y2+,故D正确;
故选C.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素在周期表的位置、元素的性质及变化规律为解答的关键,非金属性、金属性的比较方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.01mol•L-1NaOH溶液与等体积pH=2的醋酸溶液混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
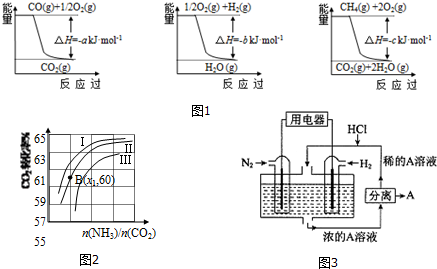
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
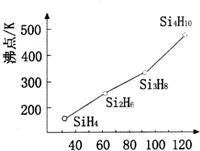 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2和CH3CH2C1都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | 米酒变酸的过程涉及氧化反应 | D. | 未成熟的苹果遇碘水不会变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验设计 |
| A | 检测溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| B | 除去CO2中的HCl | 通过饱和的NaHCO3溶液,然后干燥 |
| C | 除去乙酸乙酯中的乙酸 | 加入足量的NaOH溶液,然后分液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
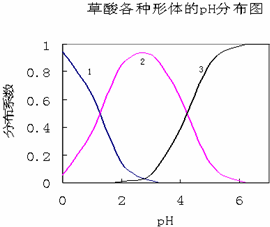 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com