
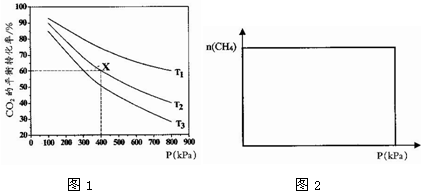
分析 (1)反应II和反应III加和可以得到反应Ⅰ,根据盖斯定律计算反应的焓变;根据反应自发进行的判据△H-T△S<0来回答;
(2)①化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不发生变化分析;
②根据温度对化学平衡移动的影响来回答判断;
③根据三行式借助v=$\frac{△c}{△t}$来计算化学反应速率和平衡常数;
④从通入CO2和CH4开始,随压强不断增大,CH4的物质的量逐渐增大,但是达到化学平衡以后,甲烷的物质的量逐渐减小;
⑤根据条件的变化硅二氧化碳的量的影响来回答.
解答 解:(1)应II和反应III嘉禾可以得到反应Ⅰ,根据盖斯定律,反应CO2(g)+CH4(g)?2CO(g)+2H2(g)△H1=41KJ•mol-1+206KJ•mol-1=+247•mol-1
,反应III的焓变△H>0,△S>0,要使得△H-T△S<0,则需要在高温下进行反应,故答案为:+247•mol-1;高温;
(2)①AV正(H2)=V逆(CO2),说明正逆反应速率是相等的,达到了平衡,故A正确;
B.CO与H2的物质的量之比保持不变,不能说明达到了平衡,故B错误;
C.容器内气体的密度等于质量和体积的比值,质量和体系的体积始终不变,所以密度始终是定值,即密度不变不一定平衡,故C错误错;
D.反应是前后气体的体积变化的反应,所以当容器内压强不变,达到了平衡,故D正确,故选AD.
②反应CO2(g)+CH4(g)?2CO(g)+2H2(g)△H1=+247•mol-1是吸热反应,温度越高,平衡正向移动,二氧化碳的转化率越大,根据图示,压强恒定,温度大小顺序是:T1>T2>T3,故答案为:T1>T2>T3;
③在压强为400KPa、T2℃的条件下,该反应6min时,
CO2(g)+CH4(g)?2CO(g)+2H2(g)
初始浓度:1 1 0 0
变化浓度:0.6 0.6 1.2 1.2
平衡浓度:0.4 0.4 1.2 1.2
用H2表示该反应的速率为$\frac{1.2mol/L}{6min}$=0.2mol•L-1•min-1,反应的平衡常数K=$\frac{1.{2}^{2}×1.{2}^{2}}{0.4×0.4}$=12.96,故答案为:0.2mol•L-1•min-1;12.96;
④从通入CO2和CH4开始,随压强不断增大,CH4的物质的量逐渐增大,但是达到化学平衡以后,甲烷的物质的量逐渐减小,即如图所示: ,故答案为:
,故答案为: ;
;
⑤A.向该反应体系中加入K2CO3溶液,可以和二氧化碳反应,符合题意,故正确;
B.降低反应体系的温度,会使得平衡逆向移动,不符合题意,故错误;
C.从反应体系中分离出H2和CO,可以促使更多二氧化碳参与反应被消耗,故正确;
D.向该反应体系中加入NH4Cl溶液,不会引起二氧化碳量的变化,故错误.
故选AC.
点评 本题综合考查学生化学反应焓变的计算、反应速率和化学平衡的计算以及化学平衡移动的影响因素等知识,属于综合知识的和考察,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | pH=10的Na2CO3溶液:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+$\frac{1}{2}$c(C2O42-) | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性X-强于Y2- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与氢氧化钠溶液 | B. | 氯化氢溶于水 | ||
| C. | 氯化氢与氨反应 | D. | 锌与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com