
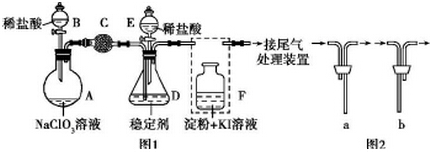
分析 (1)根据仪器特征知仪器D是锥形瓶;F装置是Cl2和KI发生的氧化还原反应,还需要连接尾气处理装置,则F装置中导气管采用长进短出原则;
(2)为使ClO2在D中被稳定剂充分吸收,二者接触的时间长些较好;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,说明Cl2被吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)根据仪器特征,可知仪器D是锥形瓶;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:锥形瓶;b;
(2)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,
故答案为:慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题考查性质实验方案设计,为高频考点,涉及基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,知道各个装置作用,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与乙醇反应比与水反应剧烈 | |
| B. | 常温下可用铝制容器贮存稀硝酸 | |
| C. | 干燥的氯气具有漂白性 | |
| D. | 用氯化铁溶液与铜反应制印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2NA | |
| B. | 每生成0.15 molH2,被还原的水分子数目为0.3NA | |
| C. | 当加入2.7gAl时,转移的电子数目为0.3NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1771年,法国科学家拉瓦锡发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系 | |
| B. | 化学科学与其他科学分支的联系不密切 | |
| C. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2 | B. | 0.5molNH3 | ||
| C. | 6.02×1023个的CH4分子 | D. | 29.4gH3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和④ | B. | ②和③ | C. | ④和⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
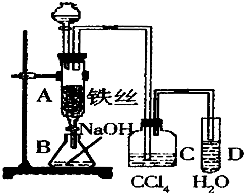 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com