
| �¶ȣ��棩 | 240 | 250 | 260 | 270 |
| ƽ����ѹǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| ƽ��������Ũ��/ mol•L-1 | 2.4��10-3 | 3.4��10-3 | 4.8��10-3 | 6.8��10-3 |
 ��
�� ���� �õ�����ɫ��ĩ1.60g��n��Fe2O3��=$\frac{1.60g}{160g/mol}$=0.01mol���������տɵõ�һ�ִ����IJ����ᾧˮ����7.10g���ɷ�Ӧ������PԪ���غ��֪������ˮ��ΪNa2SO4����n��Na2SO4��=$\frac{7.10g}{142g/mol}$=0.05mol����Ӧ�����Һ�м��뺬��3.20gNaOH����Һ��n��NaOH��=$\frac{3.20g}{40g/mol}$=0.08mol����W�к�n��Na��=0.05mol��2-0.08mol=0.02mol��W��n��O��=$\frac{2.22g-0.02mol��23g/mol-0.01mol��2��56g/mol}{16g/mol}$=0.04mol����W��Na��Fe��O��ԭ�Ӹ�����Ϊ1��1��2��WΪNaFeO2���ɽ��1������2����
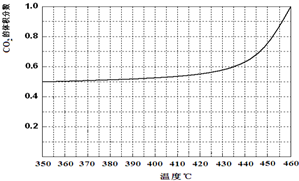
��3����ϱ�����ƽ���Ũ�ȼ���K=$\frac{������Ũ����֮��}{��Ӧ��Ũ����֮��}$���ɱ������ݿ�֪�������¶ȵ�����ƽ����ѹǿ����ƽ�������ƶ���
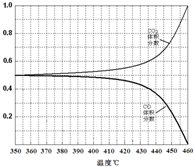
��4����ͼ������֪CO2�����������������Ӧ���ܱ������н��У�����ֻ����CO��ԭCoOת��ΪCO2����CO2���ӵ�������CO���ٵ������Դ������
��� �⣺1.60g����ɫ��ĩΪFe2O3��n��Fe2O3��=$\frac{1.60g}{160g/mol}$=0.01mol���������տɵõ�һ�ִ����IJ����ᾧˮ����7.10g���ɷ�Ӧ������PԪ���غ��֪������ˮ��ΪNa2SO4����n��Na2SO4��=$\frac{7.10g}{142g/mol}$=0.05mol����Ӧ�����Һ�м��뺬��3.20gNaOH����Һ��n��NaOH��=$\frac{3.20g}{40g/mol}$=0.08mol����W�к�n��Na��=0.05mol��2-0.08mol=0.02mol��W��n��O��=$\frac{2.22g-0.02mol��23g/mol-0.01mol��2��56g/mol}{16g/mol}$=0.04mol����W��Na��Fe��O��ԭ�Ӹ�����Ϊ1��1��2��WΪNaFeO2��
��1��������������������ϡ������������������һԪ�ص������Σ����������ƺ���Ԫ��ȫ��ת��Ϊ����������������������Һ��һ���������������տɵõ�һ�ִ����IJ����ᾧˮ���Σ������ֻ���������ƣ�������һδ֪Ԫ��ΪNaԪ�أ��ʴ�Ϊ��Na��
��2��������������֪��W�Ļ�ѧʽΪNaFeO2��W������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ2NaFeO2+4H2SO4=Na2SO4+Fe2��SO4��3+4H2O��
�ʴ�Ϊ��NaFeO2��2NaFeO2+4H2SO4=Na2SO4+Fe2��SO4��3+4H2O��
��3�����ݱ������ݣ�250��CoC2O4�ֽ��ƽ��ʱ��ƽ����Ũ��Ϊ3.4��10-3 mol•L-1����CO��CO2��ƽ��Ũ����ͬ����Ϊ1.7��10-3 mol•L-1����ƽ�ⳣ��K=c��CO��•c��CO2��=1.7��10-3��1.7��10-3=2.89��10-6���ɱ������ݿ�֪�������¶ȵ�����ƽ����ѹǿ����ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����H��0��
�ʴ�Ϊ��2.89��10-6������
��4����ͼ������֪CO2�����������������Ӧ���ܱ������н��У�����ֻ����CO��ԭCoOת��ΪCO2����CO2���ӵ�������CO���ٵ�������CO������������¶ȱ仯��������ͼ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬�漰������ɵIJⶨ����ѧƽ�ⳣ���ļ��㼰Ӱ��ƽ������صȣ����շ����ķ�Ӧ��ԭ���غ��ƶ�WΪ���Ĺؼ������ط������ƶ������Ŀ��飬ע���������ʼ���Ӧԭ�����ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
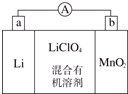 ��̵�ص����С�������������dz��õ�һ�ε�أ��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4�����ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2�� �ش��������⣺
��̵�ص����С�������������dz��õ�һ�ε�أ��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4�����ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2�� �ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϩ��������ϩ����ά�ض����ںϳɸ߷��� | |
| B�� | ��֬�����ۺ͵����ʶ���ʳ���к��е���ҪӪ�����ʣ�һ�������¶���ˮ�� | |
| C�� | ��ȥ���������е��������ᣬ�ɼ�������������Һ��ַ�Ӧ���Һ | |
| D�� | �����ͬ���칹�干��3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��Cl2ʹƷ����Һ��ɫ��ԭ����ͬ | |
| B�� | Ũ����ֱ�ʹ������ס����DZ��ʱ��Ũ������ֵ�������ͬ | |
| C�� | Ũ�����Ũ����¶���ڿ����У�Ũ�ȶ����͵�ԭ����ͬ | |
| D�� | Ũ������ϡ���ᶼ�������п��Ӧ�ų����壬������Ӧ������������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
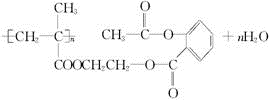
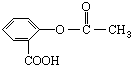 �������Խ���һ�ָ߾����������γɻ��ͳ�Чҩ�������е�һ�ֽṹ���£�
�������Խ���һ�ָ߾����������γɻ��ͳ�Чҩ�������е�һ�ֽṹ���£�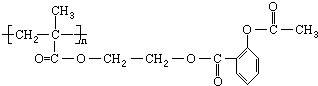
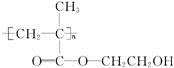 ��
��
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ѹǿ���ٷ����仯 | |
| B�� | v����CO��=v����H2O�� | |
| C�� | ����n mol CO��ͬʱ������n mol H2O | |
| D�� | 1 mol H-H�����ѵ�ͬʱ���γ�2 mol H-O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʾ����ɷ��ӹ��ɣ����Ӿ�����ԭ�ӹ��ɵ� | |
| B�� | ij���ʾ��ⶨ��ֻ����һ�����Ԫ�أ��������һ���ǵ��� | |
| C�� | �����������Ǵ�������������ʵ������ǻ���� | |
| D�� | ������������ǽ��������������������Ƿǽ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
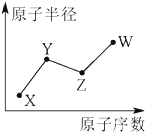 X��Y��Z��W�����ֳ����Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ����֪Y���γɻ�������������Ԫ�أ�Z��X���γ����ֳ�����Һ̬�Ļ����Wԭ�ӵ�������������Neԭ�ӵ��������������1������˵����ȷ���ǣ�������
X��Y��Z��W�����ֳ����Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ����֪Y���γɻ�������������Ԫ�أ�Z��X���γ����ֳ�����Һ̬�Ļ����Wԭ�ӵ�������������Neԭ�ӵ��������������1������˵����ȷ���ǣ�������| A�� | Y��Z��W����Ԫ��ֻ�����γ�3�ֻ����� | |
| B�� | X��Y��Z����Ԫ�ؿ��γɵĻ����ﳬ��8�� | |
| C�� | Y��W�ĺ���������ԣ�Y��W | |
| D�� | 1molX��Y����Ԫ���γɵĻ�������ȼ�գ�������������2mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com