
| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
分析 A、定容时俯视刻度线,会导致溶液体积偏小;
B、称量固体时,应左物右码,则物品的质量等于砝码的质量加游码的质量;
C、中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释不影响待测液的物质的量;
D、中和热的测定必须做好保温隔热的工作.
解答 解:A、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故A正确;
B、称量固体时,砝码错放在左盘,会导致药品的质量偏小,则所配溶液的浓度偏低,故B错误;
C、中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释不影响待测液的物质的量,对标准液的消耗量无影响,故对测定结果无影响,故C错误;
D、在敞口容器中测量氢氧化钠和稀盐酸反应的中和热会导致热量的散失,则所测中和热的数值将偏小,故D错误.
故选A.
点评 本题考查了常见实验操作中的误差分析,应注意的是在待测液中加入水或锥形瓶不干燥对测定结果无影响.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族元素的原子次外层电子数可能为2或8,不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
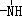 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
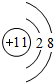 ,C的原子结构示意图是
,C的原子结构示意图是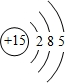 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠熔化成小球 | |
| B. | 钠块沉在乙醇液面的下面 | |
| C. | 钠块在乙醇的液面上游动 | |
| D. | 钠块表面有气泡放出,有轻微爆炸产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com