
下列实验现象、操作或反应原理的解释正确的是
| 现象、操作或反应 | 解释 |
| A.铝箔在酒精灯火焰上加热熔化不滴落 | 铝的熔点比氧化铝的熔点高 |
| B.向滴有稀硫酸的热淀粉液中滴加碘水,溶液呈蓝色 | 淀粉在此条件下未水解 |
| C.SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| D.新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH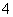 +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2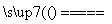 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO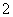 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝,用蒸馏水洗涤、干燥,称其质量为W2g,实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是( )
A.石灰水 W1<W2 B.CO W1=W2
C.NaHSO4溶液 W1>W2 D.乙醇 W1<W2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.3g乙烷中所含的共价键数目为0.6×6.02×1023
B.含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
C.相同条件下,1L CO和H2的混合气体完全燃烧消耗0.5L O2
D.相同物质的量OH-和CH3+含有相同数目的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
A.分别加水稀释10倍,四种溶液的pH为①>②>④>③
B.温度上升10℃,四种溶液的pH均不变(不考虑挥发与分解)
C.在③④中分别加入适量的醋酸铵晶体后,③的pH减小,④的pH不变
D.将①④两种溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
能在水溶液中大量共存的一组离子是( )
A.H+、I-、NO 、SiO
、SiO
B.Ag+、Fe3+、Cl-、SO
C.K+、SO 、Cu2+、NO
、Cu2+、NO
D.NH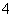 、OH-、Cl-、HCO
、OH-、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
能大量共存于同一溶液中,且当溶液中加入过量的NaOH溶液或少量稀硫酸时,都能产生白色沉淀的离子组是( )
A.Ba2+、Mg2+、NO 、CO
、CO B.H+、Ba2+、Al3+、Cl-
B.H+、Ba2+、Al3+、Cl-
C.K+、Ba2+、Cl-、HCO D.NH
D.NH 、Ba2+、Fe3+、Cl-
、Ba2+、Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
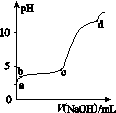
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铝、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题:
(1)铝的原子结构示意图为________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是________________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:________________________。
(3)如图K82所示的装置中,铁作________极,铜电极的电极反应式为________________。
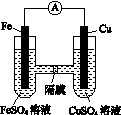
图K82
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热,并通入氯气,可得到氯化铝,同时生成CO。写出该反应的化学方程式:________________________________________。该反应中的氧化剂是________。
(6)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为____________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com