
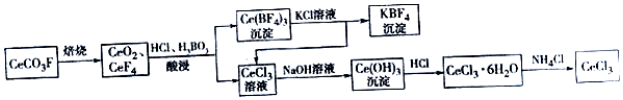
分析 由氟碳铈矿(主要成分CeCO3F)提取CeCl3的工艺流程,CeCO3F焙烧得CeO2、CeF4,用盐酸和硼酸酸浸,过滤得沉淀Ce(BF)4和CeCl3滤液,Ce(BF)4与氯化钾溶液反应得到CeCl3和KBF4,CeCl3与前面滤液中CeCl3的合并再加氢氧化钠,得Ce(OH)3沉淀,Ce(OH)3沉淀与盐酸反应可得CeCl3•6H2O,加热CeCl3•6H2O和NH4Cl的固体混合物可得到无水CeCl3,
(1)根据化合价代数和为0判断;
(2)用稀硫酸和H2O2替换HCl不会造成环境污染;在酸性条件下H2O2能还原CeO2生成Ce3+,根据元素守恒和电荷守恒书写离子方程式;
(3)Ce(BF4)3中加入KCl溶液反应生成CeCl3和KBF4;
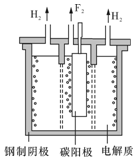
(4)根据题意K2MnF6和SbF5在 423K 的温度下反应KSbF6、MnF3、F2;阴极发生还原反应,由图可知阴极生成氢气;氟气和氢气能发生剧烈反应,引发爆炸;
(5)c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,计算c2(F-)•c(Ca2+),与Ksp(CaF2)比较可得.
解答 解:(1)根据化合价代数和为0可知,CeCO3F中,Ce元素的化合价为+3价,
故答案为:+3;
(2)酸浸过程中可用稀硫酸和H2O2替换HCl,避免产生Cl2,不会造成环境污染;稀硫酸、H2O2与CeO2反应的离子方程式为:H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑;
故答案为:避免产生Cl2,不会造成环境污染;H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑;
(3)Ce(BF4)3中加入KCl溶液反应生成CeCl3和KBF4,离子反应为:Ce(BF4)3+3K+═3KBF4+Ce3+;
故答案为:Ce(BF4)3+3K+═3KBF4+Ce3+;
(4)根据题意K2MnF6和SbF5在 423K 的温度下反应KSbF6、MnF3、F2,反应为:2K2MnF6+4SbF5$\frac{\underline{\;423K\;}}{\;}$4KSbF6+2MnF3+F2↑;电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,由图可知,阴极生成氢气发生还原反应,电极反应式为:2HF2-+2e-═H2↑+4F-;氟气和氢气能发生剧烈反应,引发爆炸,故要用镍铜合金隔板将两种气体产物严格分开;
故答案为:2K2MnF6+4SbF5$\frac{\underline{\;423K\;}}{\;}$4KSbF6+2MnF3+F2↑;2HF2-+2e-═H2↑+4F-;氟气和氢气能发生剧烈反应,引发爆炸;
(5)HF的电离平衡常数Ka=3.6×10-4,c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,c2(F-)•c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀;
故答案为:c(H+)=c(F-)=$\sqrt{3.6×10-4×0.1}$mol•L-1=6×10-3mol•L-1,c(Ca2+)=0.1mol•L-1,c2(F-)•c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,该体系有CaF2沉淀.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、电解原理、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
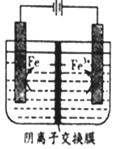
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )
二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )| A. | 乙电极为正极,发生氧化反应 | |
| B. | H+从正极区通过交换膜移向负极区 | |
| C. | 甲电极的反应式为:SO2-2e-+2H2O═SO42-+4H+ | |
| D. | 乙电极上每消耗5.6LO2时,电路中通过1mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com