
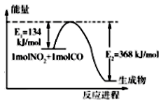
分析 (1)甲烷与水蒸汽反应制得CO和H2,每获得168L即7.5mol H2(已折算成标准状况)需消耗540KJ热量,根据热化学方程式系数的意义来回答;
(2)①B是LiNH2,液氨与金属锂反应生成氢气和LiNH2;
②在一定条件下,2.30g固体B:LiNH2与5.35gNH4Cl固体恰好完全反应,生成固体C和气体D,气体D能使湿润的红色石蕊试纸变蓝色,可推知D为NH3,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,B:LiNH2含Li,则固体B与NH4Cl固体反应可表为:LiNH2+NH4Cl→LiCl+NH3,2.30g固体B:LiNH2物质的量是0.1mol,根据Cl原子守恒,LiCl的物质的量=0.1mol,再根据质量守恒和原子守恒计算;
③B是LiNH2,根据A(s)+H2(g)$?_{释氢}^{储氢}$B(s)+LiH(s),利用元素守恒可知A的化学式,离子半径大小,Li+,H-,电子层数相同,核电荷数越大半径越小;
④B是LiNH2,根据元素守恒可知,B在加强热时发生分解反应,生成NH3和另一种化合物E为Li3N,据此书写化学方程式;
(3)根据A和E储氢量的多少选择储氢材料.
解答 解:(1)每获得168L H2(已折算成标准状况)需消耗540KJ热量,即每获得$\frac{168L}{22.4L/mol}$=$\frac{15}{2}$mol H2(已折算成标准状况)需消耗540KJ热量,故该反应的热化学方程式为$\frac{5}{2}$CH4(g)+$\frac{5}{2}$H2O(g)?$\frac{5}{2}$CO(g)+$\frac{15}{2}$H2(g)△H=+540KJ•mol-1,
故答案为:$\frac{5}{2}$CH4(g)+$\frac{5}{2}$H2O(g)?$\frac{5}{2}$CO(g)+$\frac{15}{2}$H2(g)△H=+540KJ•mol-1;
(2)①B是LiNH2,液氨与金属锂反应生成氢气和LiNH2,反应的方程式为2Li+2NH3=2LiNH2+H2↑,
故答案为:2Li+2NH3=2LiNH2+H2↑;
②在一定条件下,2.30g固体B:LiNH2与5.35gNH4Cl固体恰好完全反应,生成固体C和气体D,气体D能使湿润的红色石蕊试纸变蓝色,可推知D为NH3,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,B:LiNH2含Li,则固体B与NH4Cl固体反应可表为:LiNH2+NH4Cl→LiCl+NH3,2.30g固体B:LiNH2物质的量是0.1mol,根据Cl原子守恒,LiCl的物质的量=0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gB中含有N原子为0.1mol,35gNH4Cl为0.1mol,含有N原子为0.1mol,根据氮元素守恒,所以产生氨气是0.2mol,体积是0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
③B是LiNH2,根据A(s)+H2(g)$?_{释氢}^{储氢}$B(s)+LiH(s),利用元素守恒可知A的化学式为Li2NH,离子半径大小,Li+,H-,电子层数相同,核电荷数越大半径越小,LiH中r(Li+)小于r(H-),
故答案为:Li2NH;小于;
④推知B是LiNH2,根据元素守恒可知,B在加强热时发生分解反应,生成NH3和另一种化合物E为Li3N,反应的化学方程式为3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3,
故答案为:3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3.
(3)根据A的化学式为Li2NH,E为Li3N可知,E的储氢量要比A多,所以选择选择储氢材料E比较合理,
故答案为:E,E的储氢量要比A多.
点评 本题考查无机物推断,侧重考查学生对知识的迁移应用与综合分析解决问题能力,对学生的逻辑推理有较高的要求,把握A中含Li元素,B物质化学式的推断是解题关键,难度较大.


科目:高中化学 来源: 题型:多选题
| A. | 铜跟浓HNO3反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向水通入中NO2:3NO2+H2O═2H++2NO3-+NO | |
| D. | NH4Cl溶液和AgNO3溶液混合:NH4Cl+Ag +═Ag Cl↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述热化学方程式说明反应物的总键能大于生成物的总键能 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后加入催化剂能同时增大正逆反应速率,平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
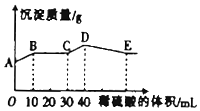 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A. | AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E点对应横坐标稀硫酸的体积为70mL | |
| C. | D点表示的沉淀的化学式为Al(OH)3、BaSO4 | |
| D. | E点沉淀比A点沉淀质量大2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有机物A的结构简式为
有机物A的结构简式为 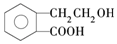 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.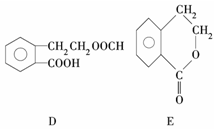
 .
. .
. +2NaOH→
+2NaOH→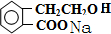 +HCOONa+H2O.
+HCOONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹(At)是第VIIA族元素,其氢化物的穆定性大于HCl | |
| B. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向蒸馏水中滴加浓硫酸的过程中,Kw保持不变 | |
| B. | 酸与碱溶液恰好完全反应时所得溶液一定呈中性 | |
| C. | 向醋酸钠溶液中加入少量冰醋酸,水的电离度减小 | |
| D. | 广泛pH试纸能够测出溶液的精确pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com