
【题目】在密闭容器中发生可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
A.v(O2)=0.01 molL﹣1s﹣1
B.v(NH3)=0.02molL﹣1s﹣1
C.v(H2O)=0.06 molL﹣1min﹣1
D.v(NO)=0.03molL﹣1s﹣1
科目:高中化学 来源: 题型:
【题目】已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度改变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行
D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示: 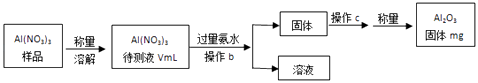
①加入过量氨水后发生反应的离子方程式为: .
②操作b为:
③Al(NO3)3待测液中,c(Al3+)=mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示: 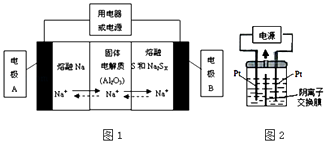
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据表数据,请你判断该电池工作的适宜应控制在(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为极,电极B发生反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为: .
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:;试分析左侧溶液蓝色逐渐变浅的可能原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,若VL甲烷(CH4)中含有的氢原子个数为n,则阿伏加德罗常数可表示为 ( )
A. Vn/22.4 B. 22.4n/V
C. Vn/5.6 D. 5.6n/V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源的开发利用与人类社会的可持续性发展息息相关.
(1)①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=a kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H2=b kJmol﹣1
O2(g)=CO2(g)△H2=b kJmol﹣1
③4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJmol﹣1
则C的燃烧热kJmol﹣1
依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号).
A.C(s)+CO2(g)═2CO(g)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)
C.2H2O(l)═2H2(g)+O2(g)
D.2CO(g)+O2(g)═2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应: .
(2)某实验小组模拟工业合成氨反应N2+3H2 ![]() 2NH3 △H=92.4 kJmol﹣1 , 开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应前压强为P.,反应过程中压强用P表示,反应过程中P/P.与时间t的关系如图2所示.请回答下列问题:
2NH3 △H=92.4 kJmol﹣1 , 开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应前压强为P.,反应过程中压强用P表示,反应过程中P/P.与时间t的关系如图2所示.请回答下列问题: 
①反应达平衡的标志是(填字母代号) .
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为 .
③若提高N2的转化率可采取的措施有 .
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1LK2SO4和CuSO4的混合溶液中,C(SO42﹣)=2molL﹣1 , 用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
A.2molL﹣1
B.3 molL﹣1
C.1molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
(1)反应物HCl中氯元素的化合价 .
(2)在该氧化还原反应中,MnO2 做剂,锰元素被 . 而HCl在反应中表现的性质包括和 .
(3)若有6molCl2生成时,反应中转移mol电子.
(4)写出该反应的离子方程式 , 用双线桥法标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
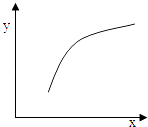
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com