
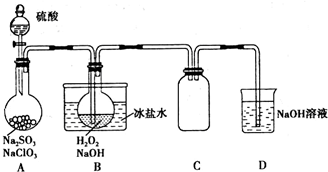
分析 实验室用NaClO3制取ClO2气体,再由ClO2制得NaClO2,由实验装置可知,A中发生2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O,必须使NaClO3稍微过量时防止生成二氧化硫,B中发生2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,由信息高于38°C时析出晶体是NaClO2,可知温度在55°C左右,蒸发结晶、过滤、洗涤、干燥得到NaClO2,NaClO2具有氧化性时可氧化亚铁离子;C作安全瓶,D吸收尾气,NaOH溶液吸收多余的ClO2,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,由Cl元素的化合价降低可知,另一种离子中Cl离子化合物为+5价,以此来解答.
解答 解:(1)装置A中产生ClO2,反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免生成SO2,故答案为:2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O;使Na2SO3完全反应,避免生成SO2;
(2)装置B中制得NaClO2,发生反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2,故答案为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
(3)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:控制溶液温度在55°C左右,蒸发结晶,趁热过滤,用38~55°C的热水洗涤,将所得结晶在低于60°C的真空中蒸发,干燥后得到成品,故答案为:趁热过滤,用38~55°C的热水洗涤;
(4)NaOH溶液吸收多余的ClO2,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,由Cl元素的化合价降低可知,另一种离子中Cl离子化合物为+5价,则另一种离子为ClO3-,故答案为:ClO3-;
(5)证明装置B反应后溶液中的NaClO2具有氧化性的方法是取B中溶液在低于60°C的温度下加热一段时间后,加入稀硫酸酸化,再加入FeCl2溶液和KSCN溶液,溶液变红证明NaClO2具有氧化性,故答案为:取B中溶液在低于60°C的温度下加热一段时间后,加入稀硫酸酸化,再加入FeCl2溶液和KSCN溶液,溶液变红证明NaClO2具有氧化性.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、混合物分离提纯为解答该题的关键,侧重分析与实验能力的考查,注意氧化还原反应及离子检验的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )| A. | 此反应可将光能转化为化学能 | |
| B. | CO2和CH4均含极性共价键 | |
| C. | 产物可能还有O2 | |
| D. | CO2溶于水呈酸性的原因:CO2+H2O?H2CO3H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea-Eb)kJ/mol | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20% | |
| D. | 将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>G>M>Y | |
| B. | X、M形成的简单阴离子的还原性:X>M | |
| C. | G与Y形成的化合物一定既能与盐酸反应,又能与烧碱溶液反应 | |
| D. | X、Z分别与Y可形成原子数为1:1的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com