
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)2NO(g)+O2 (g) (正反应吸热).实验测得:v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)c(O2 ),k正、k逆为速率常数,受温度影响.下列说法正确的是( )
容器编号 | 物质的起始浓度(molL﹣1) | 物质的平衡浓度(molL﹣1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4:5
B.达平衡时,容器Ⅱ中 c(O2 )/c(NO2 ) 比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中 NO 的体积分数小于50%
D.当温度改变为 T2时,若 k正=k逆 , 则 T2>T1
【答案】C,D
【解析】解:A.I中的反应
2NO2(g) | 2NO(g)+ | O2(g) | |
开始(mol/L) | 0.6 | 0 | 0 |
反应(mol/L) | 0.4 | 0.4 | 0.2 |
平衡(mol/L) | 0.2 | 0.4 | 0.2 |
化学平衡常数K= ![]() =0.8,容器体积为1L,则平衡时I中气体总物质的量=1L×(0.2+0.4+0.2)mol/L=0.8mol,恒容恒温时气体压强之比等于其物质的量之比,如果平衡时I、II中压强之比为4 5,则II中平衡时气体总物质的量为1mol,II中开始时浓度商=
=0.8,容器体积为1L,则平衡时I中气体总物质的量=1L×(0.2+0.4+0.2)mol/L=0.8mol,恒容恒温时气体压强之比等于其物质的量之比,如果平衡时I、II中压强之比为4 5,则II中平衡时气体总物质的量为1mol,II中开始时浓度商= ![]() =
= ![]() <0.8,则平衡正向移动,平衡正向移动导致混合气体总物质的量之和增大,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于 4 5,故A错误;
<0.8,则平衡正向移动,平衡正向移动导致混合气体总物质的量之和增大,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于 4 5,故A错误;
B.如果II中平衡时 c(NO2)=c(O2),设参加反应的 c(NO2)=xmol/L,则0.3﹣x=0.2+0.5x,x= ![]() ,
,
平衡时 c(NO2)=c(O2)= ![]() mol/L,c(NO)=0.5mol/L+
mol/L,c(NO)=0.5mol/L+ ![]() mol/L=
mol/L= ![]() mol/L,II中
mol/L,II中  ≈1.3>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),容器I中 c(O2 )/c(NO2)=1,所以达平衡时,容器Ⅱ中 c(O2 )/c(NO2 )小于1,则 比容器Ⅰ中的小,故B错误;
≈1.3>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),容器I中 c(O2 )/c(NO2)=1,所以达平衡时,容器Ⅱ中 c(O2 )/c(NO2 )小于1,则 比容器Ⅰ中的小,故B错误;
C.如果III中NO和氧气完全转化为二氧化氮,则c(NO2)=0.5mol/L,且容器中还有 c(O2)=0.1mol/L剩余,与I相比,III平衡时c(NO2)可能<0.2mol/L,不仿设某时c(NO2)为0.15mol/L,则c(NO)=0.35mol/L,c(O2 )=0.275mol/L,![]() ,此时平衡还在逆向移动,而NO 的体积分数已小于50%。故C正确;
,此时平衡还在逆向移动,而NO 的体积分数已小于50%。故C正确;
D.v正=v (NO2 )消耗=k正c2(NO2 ),v逆=v(NO)消耗=2v (O2 )消耗=k逆c2 (NO)c(O2 ),
达到平衡状态时正逆反应速率相等,则k正c2(NO2 )=k逆c2 (NO)c(O2 ),且k正=k逆 , 则c2(NO2 )=c2 (NO)c(O2 ),化学平衡常数K等于1,该温度下的K大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1 , 故D正确;
故选CD.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】加“碘”食盐较多使用的碘酸钾(KIO3),在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O ![]() KIO3+3H2↑.下列有关说法不正确的是( )
KIO3+3H2↑.下列有关说法不正确的是( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I﹣﹣6e﹣+3H2O═IO3﹣+6H+
C.溶液调节至强酸性,对生产不利
D.电解后阴极周围溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉主要是奶粉中含有有毒的三聚氰胺(  ).下列关于三聚氰胺分子的说法中正确的是( )
).下列关于三聚氰胺分子的说法中正确的是( )
A.所有氮原子均采取sp3杂化
B.一个三聚氰胺分子中共含有15个σ键
C.属于极性分子
D.三聚氰胺分子中同时含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】口服含13C 的尿素胶囊,若胃部存在幽门螺杆菌,尿素会被水解形成13CO2,医学上通过检测呼出气体是否含13CO2,间接判断是否感染幽门螺杆菌,下列有关说法正确的是( )
A.13CO2和12CO2互称同位素B.13C原子核外有2个未成对电子
C.尿素属于铵态氮肥D.13C的质量数为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为( )
A.Fe-2e-===Fe2+
B.2H++2e-===H2↑
C.2H2O+O2+4e-===4OH-
D.Fe-3e-===Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL18molL﹣1浓硫酸中加入20g铜粉,加热一段时间后,冷却,过滤,得剩余固体7.2g.
(1)标准状况下,产生气体的体积是多少?(假设产生的气体全部放出)
(2)将最终所得溶液稀释至1L,滴加2molL﹣1的氢氧化钠溶液,若要使溶液中的Cu2+全部沉淀,需加入该氢氧化钠溶液的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )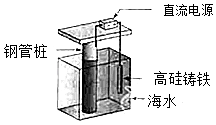
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( ) 
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水橙色褪去
D.含酚酞的NaOH溶液红色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com