
下列事实不能用于判断元素金属性强弱的是( )
A.1 mol金属单质在反应中失去电子的多少
B.金属单质之间发生的置换反应
C.金属元素最高价氧化物对应的水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢气的难易程度
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可以计算某些难于直接测量的反应的反应热
D.△H大于零的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是 (填字母序号)。
A. 将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。
B. 在FeCl3溶液中加入足量的NaOH溶液
C. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为 。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3 + 2KI = 2FeCl2 + I2 +2KI
在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 色,再将混合液倒入 (填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列常数表达式不正确的是:
A.2SO2(g)+O2(g)  2SO3(g)的化学平衡常数表达式为
2SO3(g)的化学平衡常数表达式为
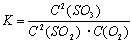
B.NH3·H2O的电离平衡常数表达式为
C. 溶度积常数表达式为
溶度积常数表达式为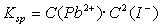
D. SO2(g)+ O2(g)  SO3(g)的化学平衡常数表达式为
SO3(g)的化学平衡常数表达式为
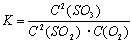
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
 (4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸
(填“强”或“弱”)。
②在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”)
③K点对应的溶液中, c(M+)+c(MOH)= mol·L-1。
(5)在25 ℃下,向浓度均为0.01 mol·L-1的FeCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),当测得溶液pH=11时,则此温度下残留在溶液中的c(Cu2+):c(Fe3+)
= 。
(已知25℃时Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cu(OH)2]=2.2×10-20)
(6)25℃时,将bmol NH4NO3溶于水,向该溶液滴加aL氨水后溶液呈中性,则所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb = 2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
B.用氯水、淀粉KI溶液比较Cl2与I2的氧化性强弱所需仪器是试管、胶头滴管
C.将混有HCl的Cl2气体通入饱和NaHCO3溶液中除去HCl
D.已知火柴头中有氧化剂KClO3,在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②通入的过量Y是CO2气体
D.图中所示的转化反应①②都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关实验的说法正确的是
A.向盛有碘水的分液漏斗中加入无水乙醇,振荡、静置,放出有机层后再蒸馏,提取碘水中的碘
B.取淀粉、稀硫酸共热后的溶液与新制Cu(OH)2反应,无红色沉淀生成,说明淀粉未水解
C.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
D.为除去粗盐中的Ca2+、Mg2+、SO42-,先后加入的试剂是H2O、Ba(OH)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(III)的化学方程式 。
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,反应(III)的离子方程式为 。
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(III)中氧化产物与还原产物的物质的量之比为 。0.1mol A与含0.15 mol NaOH的溶液充分反应后,溶液中所含离子浓度的大小关系为 。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为 ,D的电子式为 。
②25℃时,0.1mol·L-1 B、C溶液,pH较大的是 溶液(填溶质的化学式),写出B溶液中微粒浓度之间存在的等量关系 (写出一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com