
【题目】下列反应的离子方程式书写正确的是 ( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH=AlO2+H2
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.Fe(OH)3跟盐酸反应:OH+H+= H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
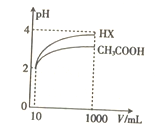
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铵分解反应中,生成的含氮产物中仅有氮气和硝酸两种,其中被氧化的氮元素和被还原的氮元素物质的量之比为( )
A. 5:3 B. 1:1 C. 5:4 D. 3:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为
A. (3.5 , 5.0) B. (3.5 , 7.1)
C. (5.0 , 7.1) D. ( 4.0 , 7.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL 某浓度的盐酸中,混合物完全溶解,当再加入250mL、2.00molL﹣1的NaOH溶液时,得到沉淀最多.上述盐酸的浓度为( )
A.1.00 molL﹣1
B.0.500 molL﹣1
C.2.00 molL﹣1
D.3.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的体积约为22.4L的是( )
A.标准状况下1molH2O
B.20℃、101kPa时36.5gHCl
C.常温常压下17gNH3
D.标准状况下0.4mol H2和0.6molO2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
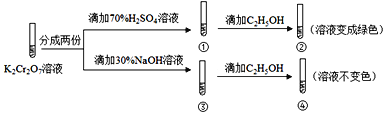
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com