
| A. | LiH和D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| B. | 1 mol LiAlH4在125℃完全分解转移3 mol电子 | |
| C. | LiH与水反应的化学方程式为LiH+H2O═LiOH+H2↑ | |
| D. | LiH中微粒半径r(Li+)<r(H-) |
分析 A.依据LiH与D2O反应方程式:LiH+D2O=HD↑+LiOD,判断;
B.依据LiAlH4在125℃分解为LiH、H2和Al的化学方程式计算;
C.LiH与水发生氧化还原反应生成氢氧化锂和氢气;
D.核外电子排布相同时,原子序数越小,半径越大.
解答 解:A.LiH与D2O反应方程式:LiH+D2O=HD↑+LiOD,所以所得氢气的摩尔质量为3g/mol,故A错误;
B.LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4在125℃时完全分解,转移3 mol电子,故B正确;
C.LiH与水发生氧化还原反应生成氢氧化锂和氢气,方程式:LiH+H2O=LiOH+H2↑,故C正确;
D.Li+、H-核外电子排布相同,原子序数越小,半径越大,故Li+半径小于H-,故D正确;
故选:A.
点评 本题考查了氧化还原反应、元素化合物性质,侧重考查氢化锂的性质,熟悉氢化锂中氢为-1价是解题关键,注意对所给条件的分析和应用,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2<$\frac{{Q}_{1}}{2}$ | C. | Q2>$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
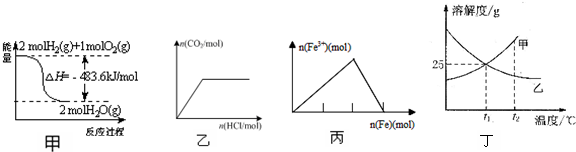
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 | |
| C. | 丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+浓度的变化曲线 | |
| D. | 丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶入100mL水中 | 配制4mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1~2mLFeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性强弱 |
| D | 用熔融氧化铝、CCl4做导电性实验 | 验证两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 1mol Na2CO3晶体中含 CO${\;}_{3}^{2-}$离子数小于1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液,溶液呈红褐色:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HS03- | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向明矾溶液中滴加少量Ba(OH)2:2Al3++3SO4 2-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据上述步骤Ⅱ可以得出m(Fe2O3):m(Cu)=1:1 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO${\;}_{4}^{2-}$ | |
| B. | Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- | |
| C. | H2CO3的电离:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 水溶液中的NaHSO4电离:NaHSO4═Na++HSO${\;}_{4}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com