
【题目】下列离子方程式正确的是( )
A.二氧化锰和浓盐酸反应:MnO2+4HCl浓═Mn2++2Cl2↑+2H2O
B.二氧化硅和氢氧化钠溶液反应:SiO2+2 Na++2OH﹣═Na2SiO3+H2O
C.碳酸钡和稀硝酸反应:CO32﹣+2H+═CO2↑+H2O
D.铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。
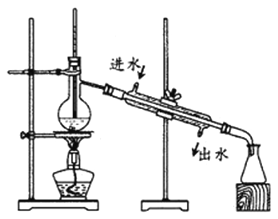
(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f是前四周期原子序数依次增大的6种元素,a元素的基态原子核外s能级上的电子数是p能级上电子数的2倍;c元素原子的最外层电子数是次外层电子数的3倍;d是地壳中含量最高的金属元素;e的正三价基态离子的d能级为半充满结构;f的基态原子最外层只有一个电子,且内层电子排布均为全充满结构。
(1)b元素基态原子的价电子排布图为________。
(2)a、b、c三种元素的第一电离能由大到小的顺序为_________。(用元素符号回答)
(3)b与c组成的一种分子甲中有16个价电子,甲分子与______(填写一种物质的分子式)是等电子体,甲分子中σ键和π键的数目比是______。
(4)c的氢化物中,电子总数为18的分子是乙,乙中c原子的杂化方式为_______。它是______分子(填“极性”或“非极性”)
(5)已知c、f能形成两种化合物,其晶胞如图所示,甲的化学式为_________。高温时,甲易转化为乙的原因为_________。

(6)e元素对应的单质在形成晶体时,采用如图所示的堆积方式_________。则这种堆积模型的配位数为,如果e的原子半径为 r pm;阿伏伽德罗常数的值为NA,计算此单质的密度表达式为_______g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1) 区分晶体硼和无定形硼最可靠的科学方法为___________。第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位,其基态原子价层电子的电子云轮廊图为 _______________。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3) N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有______伸展方向。

(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g· cm-3(用含α、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述中正确的是( )
A.第IA族元素都是金属元素
B.第VIA族元素的单质在常温下均为气体
C.第二、三周期中的金属元素种类一 样多
D.短周期包括第一、二、三周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com