
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,则石墨的燃烧热为110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故该反应一定能自发进行 | |
| D. | 热化学方程式中的化学计量数表示物质的量,可以是分数 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、依据燃烧热的概念分析判断,生成的一氧化碳不是稳定氧化物;
C、结合反应特征依据△H-T△S<0分析判断;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数.
解答 解:A、氢气燃烧热是放热反应,焓变为负值,其燃烧的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.5 kJ•mol-1,故A错误;
B、已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,生成的一氧化碳不是稳定氧化物,燃烧热是1molC燃烧生成稳定氧化物二氧化碳放出的热量,故B错误;
C、N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,△S<0,只有低温下符合△H-T△S<0,该反应不一定能自发进行,故C错误;
D、热化学方程式的化学计量数表示物质的量,可以是整数也可以是分数,故D正确;
故选D.
点评 本题考查了反应焓变、熵变与反应自发进行的判断依据,主要是书写方法和表达意义,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:填空题
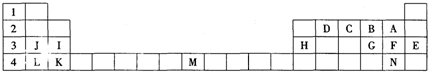
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 加压 | B. | 增加O2的浓度 | ||
| C. | 使用催化剂 | D. | 同时增大SO3和O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
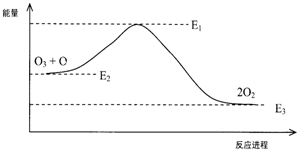 氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )
氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )| A. | 反应O+O3=2O2的△H=E1-E3 | B. | O+O3=2O2是放热反应 | ||
| C. | △H=△H1+△H2 | D. | 反应O+O3=2O2的△H=E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (n+0.2)mol | B. | (n+0.4)mol | C. | 0.28 mol | D. | 0.31 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴加试剂 | 所根据的现象 | 结论 |
| 不是盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com