
| A. | 氧化铝是一种高硬度、高熔沸点的化合物 | |
| B. | 铝是活泼的金属,其合金抗腐蚀能力差 | |
| C. | 铝合金具有密度小、高强度及较好的可塑性 | |
| D. | 铝合金可用于制飞机骨架等 |
科目:高中化学 来源: 题型:选择题
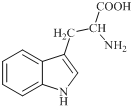 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )| A. | 色氨酸的分子式为C11H12N2O2 | |
| B. | 色氨酸能发生取代、加成、酯化、中和反应 | |
| C. | 色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐 | |
| D. | 将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
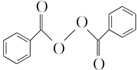 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: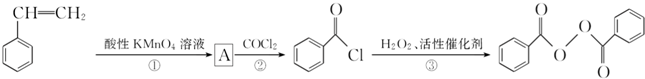
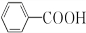 ;②的反应类型为取代反应.
;②的反应类型为取代反应.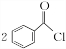 +H2O2$\stackrel{活性催化剂}{→}$
+H2O2$\stackrel{活性催化剂}{→}$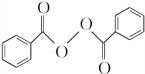 +2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为
+2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为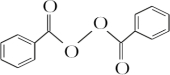 +2H2O$\stackrel{H+}{→}$
+2H2O$\stackrel{H+}{→}$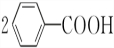 +H2O2.
+H2O2. )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.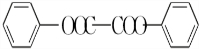 (或
(或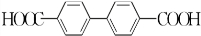 或
或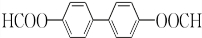 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆科植物通过根瘤菌吸收空气中的氮是化学变化 | |
| B. | 化石燃料燃烧通常不释放出氮氧化合物 | |
| C. | 汽车尾气中排放的氮氧化合物是由游离态氮转化来的 | |
| D. | 植物秸秆燃烧时放出氮氧化合物,参与了氮的循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
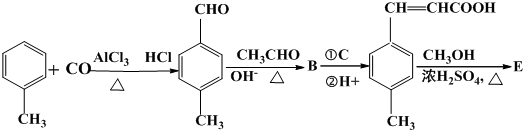
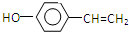 ;
;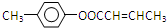 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为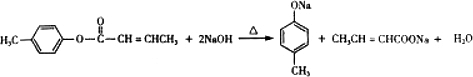 .
.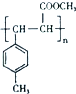 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
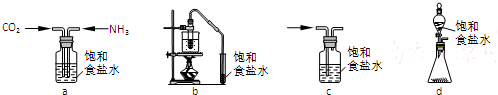
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com