
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池中电极b是正极 | |
| B. | 外电路中电子由电极b通过导线流向电极a | |
| C. | 该电池的正极反应为O2+4H++4e-=2H2O | |
| D. | 该电池的总反应:2H2+O2=2H2O |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;氢氧燃料电池的产物是水;氢氧燃料电池的正负极反应物分别为氢气和氧气,氢气和氧气可以储存在电池外部的容器中.
解答 解:A.燃料电池中,通氧气的一极为正极,故b为正极,故A正确;
B.外电路中电子由负极到正极,所以由电极a通过导线流向电极b,故B错误;
C.该电池的正极反应为O2+4H++4e-=2H2O,故C正确;
D.氢氧燃料电池的正负极反应物分别为氢气和氧气,该电池的总反应:2H2+O2=2H2O,故D正确.
故选B.
点评 本题考查了燃料电池,侧重于原电池原理的考查,题目难度不大,注意氢氧燃料电池的反应产物为水,环保无污染.


科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的主要成分是金属铅 | |
| B. | CO气体有毒,在生有炉火的居室中多放几盆水,可吸收CO | |
| C. | 含磷洗衣粉的大量使用会造成水体富营养化 | |
| D. | 水泥、玻璃、塑料都是高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 其溶液的pH=13 | |
| C. | 用HNO3溶液完全中和后,溶液显中性 | |
| D. | 加入少量NH4Cl固体后,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$比值变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中共价键越强,熔点越高 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 氯化钠晶体熔化时离子键发生断裂 | |
| D. | 金属晶体熔化时金属键未发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | 有3molCl2参加反应,就有6NA个电子转移 | |
| C. | 被还原的氯原子和被氧化的氯原子的个数比是1:1 | |
| D. | 被还原的氯原子和被氧化的氯原子的个数比是5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
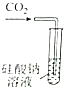 | 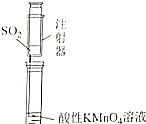 | 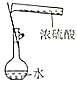 | 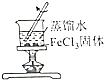 |
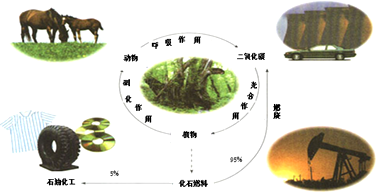
| 证明碳的非金属性比硅强 | 探究SO2的漂白性 | 配制一定物质的量浓度的稀硫酸 | 制取少量Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
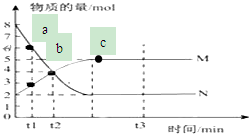 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com